Реферат: Общие свойства молекулярных орбиталей
Пример (кратко о бутадиене):
Корни ВД и уровни -МО: X1,2,3,4 = ± (1 ± 51/2 )/2.
(E1,4 , E2,3 )=(±=±).
Матрица нормированных составов МО построена всего из двух чисел:
(0.3717; 0.6015)
Профильные диаграммы амплитуд МО.
Уровни. Конфигурация. Числа заполнения.
Минимальное понятие о топологии молекулярной структуры: центры-атомы, рёбра-связи. Индексы электронной структуры:
Атомные : Заселённости АО парциальные и полные.
Для связей : Заселённости связей (порядки связей) парциальные и полные. Полные порядки пи-связи равны (2´2´ab; 2´(a2 -b2 );)=(0.894; 0.263) » (0.9; 0.3) Хюккелевские порядки связей. Порядок связи и длина (корреляия).
| |CC|, Ao | p p | Молекула | Примечание |
| 1.54 | 0 | Этан | |
| 1.45 | 0.5 | Графит | Экстрапол. по –C< |
| 1.397 | 2/3 | Бензол | |
| 1.33 | 1 | Этен | |
| 1.22 | 2 | Этин |
Свободные валентности
Индекс свободной валентности (у бутадиена): F1,4 =31/2 -0.9»0.8; F2,3 =31/2 -0.9-0.3»0.5.
Альтернантные УВ и две теоремы об АУВ: 1) Уровни. 2) Заселённости АО. Сопряжение и Ароматичность. Алкены. Арены. Алкины. Длина связи CC.
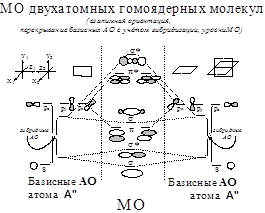
Двухатомные гомоядерные молекулы. Гибридизация орбиталей: -модельный случай у плоского ротатора. Кривая зависимости ПИ(Z) для 2s-2p АО и гибридизация (s±p)-АО у атомов элементов 2-го периода. Пиктограммы гибридных АО.
Две корреляционные схемы уровней АО- МО у элементов 2-го периода
(атомы и 2-х атомные молекулы).
Схема А: Вариант с гибридизацией АО,
Схема Б: Вариант без гибридизации АО.
Последовательности уровней МО:
Схема А:1g <1u <2g <2u <1 u <3 g <1g <3u
Схема Б: 1g <1u <2g <2u <3 g <1 u <1g <3u
Конфигурации и параметры 2-х атомных молекул и молекулярных ионов.
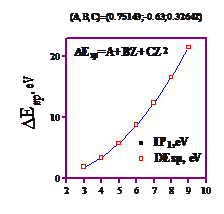
Дистанции E(2s)-E(2p) у элементов 2-го Периода Системы Менделеева
| H | Li | Be | B | C | N | O | F | Ne | |
| Z | 1 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 1-й ПИ , эВ | 13.62 | 5.377 | 9.281 | 8.28 | 11.23 | 14.48 | 13.57 | 17.37 | 21.509 |
| ЭС, эВ | 0.747 | 0.82 | -0.19 | 0.38 | 2.1;1.12 | 0.05 | 1.465 | 3.58;3.50 | - |
| E 2s2p , эВ | теор. | 1.85 | 3.36 | 5.76 | 8.77 | 12.39 | 16.53 | 21.54 |
График этой зависимости имеет вид гладкой функции.
Она очень неплохо аппроксимируется параболой: E=A+BZ+CZ2
| ||||
| ||||
| ||||
ПРОБЛЕМЫ: Связь и разрыхление. Длины связей. Энергии связи. Силовые постоянные собственных колебаний. Устойчивость конфигураций. Баланс «связь-разрыхление» и кратность связи по Герцбергу: PГ =(1/2)´ (n-n*).
Свойства гомоядерных двухатомных молекул элементов 2-го периода Системы Менделеева
| P Г | R0 , Ао | D, эВ | D, кДж/моль | Терм |
k´10-5 , дн/см |
К-во Просмотров: 279
Бесплатно скачать Реферат: Общие свойства молекулярных орбиталей
|