Реферат: Опыты Франка и Герца
Эксперименты Франка и Герца не только продемонстрировали существование квантов энергии более убедительно, чем любая предшествующая работа, но и дали новый метод измерения постоянной Планка. Более того, их результаты явились экспериментальным подтверждением боровской модели атома. Ни Франк, ни Герц не поняли этого вначале, обратив мало внимания на предположение Бора. Однако Бор и другие вскоре воспользовались результатами Франка и Герца, чтобы подтвердить идеи Бора, оказавшие глубокое влияние на развитие квантовой теории.
В 1926 году Шведская королевская академия наук наградила Нобелевской премией по физике за 1925 год Франка и Герца "за открытие законов соударений электронов с атомами". В своей Нобелевской лекции Франк указал, что "первые работы Нильса Бора по теории атома появились за полгода до окончания этой работы". "Впоследствии, - продолжал он, - мне казалось совершенно необъяснимым, почему мы не осознали фундаментального значения теории Бора, причем до такой степени, что ни разу даже не упомянули о ней в своем научном докладе".
Исследования Франка были прерваны разразившейся в 1914 году Первой мировой войной. Он служил офицером на русско-германском фронте, затем из-за тяжелого заболевания дизентерией был отправлен в тыл для длительного лечения. В 1917 году Франк стал главой секции в Институте физической химии кайзера Вильгельма, работая под руководством Фрица Хабера. Там он продолжил свои исследования по неупругим столкновениям электронов с атомами и молекулами. Франк и его коллеги обнаружили, что электроны могут возбудить атом (заставив его поглотить энергию) таким образом, что он не сможет освободиться от возбуждающей энергии, испуская свет. Такие атомы находятся в "метастабильном состоянии", по терминологии, введенной Франком и его сотрудниками, и способен потерять энергию возбуждения только при соударении с частицами. Метастабильные состояния играют важную роль в химии и физике: при фотосинтезе, например, они являются решающими при накоплении энергии в растениях. Позднее Франк обратился к фотосинтезу, который оставался самым важным для него предметом научных исследований последние 30 лет его жизни.
Когда Максу Борну в 1912 году предложили возглавить кафедру теоретической физики в Геттингенском университете, он согласился при условии, что Франк возглавит кафедру экспериментальной физики. Следующие 12 лет двое ученых работали в тесном контакте, обсуждая друг с другом каждый аспект своей работы. Когда Борн начал разрабатывать формальный математический аппарат квантовой теории, которую он назвал квантовой механикой, глубокая научная интуиция Франка оказалась для него бесценной. В Геттингене Франк вначале изучал взаимодействия атомов с электронами, светом и другими атомами. Его работа по формированию и структуре молекул, где использовались молекулярные спектры, позволила ему определить основные химические свойства по спектроскопическим измерениям. Подход, который он разработал со своим коллегой Эдвардом Кондоном, известен как принцип Франка-Кондона.
Вскоре после того, как Адольф Гитлер стал рейхсканцлером (1933), германское правительство стало удалять евреев с академических постов. Хотя Франк и был евреем, но его заслуги в период Первой мировой войны вначале ограждали его от смещения с поста. Он тем не менее сам подал в отставку, поскольку не хотел выполнять указание об увольнении сотрудников и студентов еврейской национальности. Он заявил о своем несогласии публично, что было актом личного мужества. Перед тем как покинуть Германию, Франк, несмотря на экономическую депрессию, сумел найти работу за границей для каждого члена своей лаборатории.
Проработав год в Исследовательском институте Бора в Копенгагене, Франк в 1935 году эмигрировал в Соединенные Штаты, став профессором Университета Джонса Хопкинса. Здесь он стал изучать влияние света на химические вещества и начал работы по разгадке тайн фотосинтеза, фундаментального фотохимического процесса в природе. В 1938 году он был назначен профессором физической химии и директором новой лаборатории фотосинтеза Чикагского университета. Три года спустя он стал американским гражданином.
После вступления США во Вторую мировую войну Франк руководил химическим отделом металлургической лаборатории Чикагского университета, являвшейся составной частью Манхэттенского проекта по созданию атомной бомбы. Хотя перспектива создания ядерного оружия была ему ненавистна, он опасался, что Германия идет к той же цели. После поражения Германии Франк возглавил комитет, изучавший социальные и политические последствия применения ядерного оружия. В докладе комитета, сделанном в июне 1945 года и известном как "доклад Франка", настаивалось на том, чтобы ядерное оружие не применялось в военных целях до тех пор, пока оно не будет продемонстрировано в каком-нибудь необитаемом месте представителям всех наций, в особенности японцам. Доклад также предсказывал опасность гонки ядерных вооружений. Этими рекомендациями пренебрегли, и японские города Хиросима и Нагасаки были разрушены в августе этого же года.
В 1907 году Франк женился на Ингрид Йозефсон, у них было две дочери. Ингрид Франк умерла в 1942 году после продолжительной болезни. В 1946 году Франк женился на Герте Спонер, своей бывшей студентке, которая стала профессором физики Дьюкского университета в Дареме (штат Северная Каролина). После Второй мировой войны Франк вернулся к своим исследованиям в Чикагском университете, деля время между Чикаго и семейным домом в Дареме. В 1949 году он стал почетным профессором в отставке Чикагского университета и продолжал вести активные исследования, особенно по фотосинтезу.
Франк умер внезапно, когда они с женой в 1964 году гостили у друзей в Геттингене.
Коллеги знали Франка как доброго, мягкого, демократичного человека, и многие из них неоднократно обращались к нему за советом по научным и личным делам. Они вспоминают его публичный протест против нацистов и его попытку предотвратить использование атомной бомбы против гражданского населения как примеры морального мужества.
Кроме Нобелевской премии, Франк получил медаль Макса Планка Германского физического общества (1951) и медаль Румфорда Американской академии наук и искусств (1955). В 1953 году он стал почетным гражданином Геттингена. Франк был членом многих научных организаций, включая американскую Национальную академию наук, Ассоциацию содействия развитию науки, Американское философское общество, Американское химическое общество, Американское ботаническое общество и Лондонское королевское общество.
Совместная работа Франка и Герца.
Опыты Франка и Герца (1913 г) явились прямым подтверждением постулатов Бора (1913г ), которые гласили:
1. Из бесконечного множества электронных орбит атома, допускаемы классической механикой, в центральном поле могут существовать только некоторые, образующие дискретный ряд, удовлетворяющий постулату Бора о квантовании момента количества движения электрона (этот постулат мы рассматривать здесь не будем). Электрон, находящийся на одной из этих орбит, обладает энергией Еn (n - номер орбиты) и при движении по ней не излучает электромагнитных волн, хотя и движется с ускорением. Такая орбита называется стационарной.
Таким образом, внутренняя энергия атома представляет некоторый набор (хотя и бесконечный, но определенный) ДИСКРЕТНЫХ уровней энергии, которые в простейшем случае для атома водорода изображены на Рис.1.
Если электрон, например в атоме водорода, двигается по одной из стационарных орбит, то он находится на одном из этих уровней (следует иметь в виду, что под Еn подразумевается полная энергия, т.е. E = Tкин + Vпот). E1 – это самый нижний уровень, орбита которого ближе всего к ядру. Если каким-либо образом передать энергию атому, с учетом рассмотренной схемы уровней, то мы подойдем ко второму постулату Бора:
2. Изменение внутренней энергии, ее поглощение или испускание возможно только порциями - квантами. При переходе электрона из одного n-го состояния с энергией En в другое, m-ое состояние с энергией Em величина этого кванта не может быть больше или меньше разности этих уровней энергии и равна точно ΔE = En – Em.
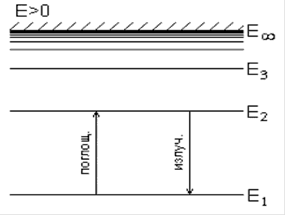
Рис.1 Схема энергетических уровней атома водорода.
Уровни энергии, как видно на схеме рис.1, сгущаются с ростом номера n.
При комнатной температуре подавляющее большинство атомов находится в основном состоянии - на уровне E1, наиболее сильно связанном с ядром. Все остальные уровни - E2, E3 и т.д. называются возбужденными, а уровень E∞ соответствует значению внутренней энергии, равной нулю, начиная с него электрон теряет связь с ядром и становится свободным. Для того, чтобы произошло возбуждение или отрыв (ионизация) электрона, ему необходимо передать энергию ΔE ≥ |En - E1| (возбуждение) или ΔE ≡ I = |E∞ - E1| (ионизация).
Все уровни энергии, соответствующие связанным состояниям электрона, обладают отрицательной энергией, а свободные электроны - положительной, эта часть спектра находится выше E∞ и называется непрерывным спектром в отличие от дискретного спектра. Таким образом , в представленной шкале энергий на рис.1 ноль находится при E∞, ниже все значения энергии отрицательны, а выше - положительны.
Отсчет энергии можно вести и от самого нижнего уровня, полагая, что ноль находится при E1, такую шкалу можно назвать шкалой энергий возбуждения, а энергию, например, ΔE12 = E2 - E1 - энергией перехода в возбужденное состояние E2. Если постулаты Бора верны, то можно было бы опытным путем проверить их, например, обстреливая атом электронами, кинетическая энергия которых Tкин ≥ ΔE12. В этом и только этом случае произошел бы переход E1 →E2, возможны также переходы E1 → E3 и т.д. однако условия упрощенного опыта приводят, как правило, только к переходам E1 → E2. Впервые этот опыт был поставлен Франком и Герцем в 1913г. Идея эксперимента состояла в том, чтобы, обстреливая атомы определенного газа электронами регулируемой энергии, следить за энергетическими потерями этих электронов. Исходя из этого, Франк и Герц сконструировали прибор, который , по существу, представлял ламповый триод (рис. 2) с катодом K, сеткой С и анодом A, заполненный парами ртути при давлении ∼ 1мм ртутного столба.
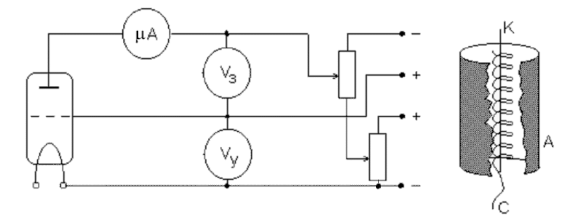
Рис.2 Принципиальная схема измерения вольтамперных характеристик газонаполненного триода.
Между катодом и сеткой прикладывалось ускоряющее электроны напряжение Vy ( энергия их eVy), а между сеткой и анодом – задерживающее напряжение Vз. Задерживающее напряжение обычно выбиралось небольшим и играло роль селектора электронов, направляя медленные электроны, потерявшие скорость после неупругих столкновений, на сетку.
Рассмотрим более подробно процессы, происходящие в такой лампе, ее вольтамперные характеристики iA(Vу) - зависимость анодного тока от ускоряющего напряжения Vу (назовем ее анодной характеристикой), и характеристику iA(Vз) – зависимость анодного тока от напряжения задержки (назовем ее характеристикой задержки). Для более полного понимания характера поведения вольтамперных характеристик полезно изучить влияние на них концентрации атомов в колбе лампы. Если концентрацию атомов уменьшить, доведя ее до такой величины, когда число столкновений с электронами будет ничтожно мало, то такую лампу можно считать вакуумной. Прежде всего, полезно изучить вольтамперную характеристику вакуумной лампы.
Вакуумная лампа
Анодная характеристика. Вакуум в лампе должен быть таким, чтобы не было столкновений электронов с остаточным (после откачки) газом лампы. Это означает, что средняя длина свободного пробега электрона λ в таком сосуде должна быть много больше размеров этой лампы L, (λ >>L). Однако вполне подходит и менее жесткое условие λ>L. Такое условие может быть выполнено для лампы, наполненной парами ртути при комнатной температуре (Т≈200С). В этом случае давление паров ртути невелико и условие λ>L обычно выполняется.