Реферат: Основи формальної кінетики. Швидкість хімічної реакції
А → Продукти реакції
Швидкість реакції першого порядку дорівнює:
![]() (6)
(6)
де ![]() - коефіцієнт швидкості процесу, (константа швидкості реакції);
- коефіцієнт швидкості процесу, (константа швидкості реакції);
С - поточна концентрація речовини А.
Інтегруючи рівняння (6), одержимо
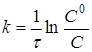 (7)
(7)
де С 0 і С - початкова і поточна концентрації речовини А.
Рівняння (7) можна представити у вигляді
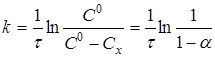 (8)
(8)
де Сх - зміна концентрації речовини А за час τ ;
![]() - ступінь перетворення.
- ступінь перетворення.
Якщо 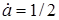 , то
, то
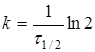 (9)
(9)
![]() (10)
(10)
де ![]() - час напіврозпаду, тобто час, протягом якого прореагує половина речовини.
- час напіврозпаду, тобто час, протягом якого прореагує половина речовини.
Однобічна хімічно необоротна реакція другого порядку схематично може бути представлена рівнянням
А 1 + А 2 → Продукт (продукти) реакції
Швидкість реакції другого порядку дорівнює
![]() (11)
(11)
де С 1 і С 2 – поточні концентрації А 1 і А 2 .
Інтегруючи рівняння (11), одержуємо
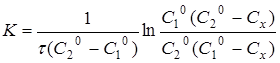 (12)
(12)
Якщо С 1 =С 2 =С , то рівняння (11) прийме вигляд
![]() (13)
(13)
і після інтегрування
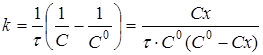 (14)
(14)
при С =С 0/2
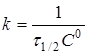 (15)
(15)
![]() (16)
(16)
Час напівперетворення ![]() для реакції другого порядку зворотньо пропорційний початковій концентрації реагуючих речовин.
для реакції другого порядку зворотньо пропорційний початковій концентрації реагуючих речовин.
У випадку однобічної реакції п-го порядку