Реферат: Основные методы умягчения воды
Более глубокое умягчение воды может быть достигнуто ее подогревом, добавлением избытка реагента-осадителя и созданием контакта умягчаемой воды с ранее образовавшимися осадками. При подогреве воды уменьшается растворимость СаСО3 и Mg (OH) 2 и более полно протекают реакции умягчения.
Из графика (рис. 2, а) видно, что остаточная жесткость, близкая к теоретически возможной, может быть получена только при значительном подогреве воды. Значительный эффект умягчения наблюдается при 35.40°С, дальнейший подогрев менее эффективен. Глубокое умягчение ведут при температуре выше 100° С. Большой избыток реагента-осадителя при декарбонизации добавлять не рекомендуется, так как возрастает остаточная жесткость из-за непрореагировавшей извести или при наличии в воде магниевой некарбонатной жесткости вследствие ее перехода в кальциевую жесткость:
MgS04 + Са (ОН) 2 = Mg (ОН) 2 + CaS04
Поэтому рекомендуется принимать избыток извести не более 0,5 мг-экв/л. Зависимость остаточной жесткости воды от дозы извести приведена на рис. 2, б.
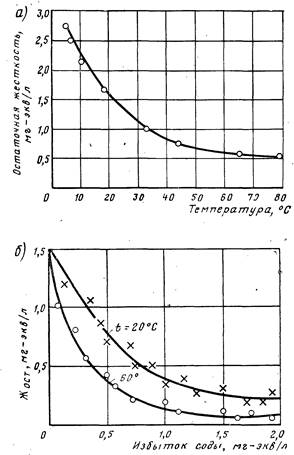
Рис. 2. Влияние температуры (а) и дозы извести (б) на глубину умягчения воды известково-содовым и известковым методом
При известково-содовом методе также не рекомендуется применять большие избытки извести, однако, в данном случае они не вызывают увеличения остаточной жесткости, поскольку снимаются содой
Са (0H) 2 + Na2 C03 = CaC03 +2NaOH,
но избыток извести приводит к нерациональному перерасходованию соды, повышению стоимости умягчения воды и увеличению гидратной щелочности. Поэтому избыток соды принимают около 1 мг-экв/л. Жесткость воды в результате контакта с ранее выпавшим осадком понижается на 0,3.0,5 мг-экв/л п сравнению с процессом без контакта с осадком.
Контроль процесса умягчения воды следует осуществлять коррекцией рН умягченной воды. Когда это невозможно, его контролируют по значению гидратной щелочности, которую при декарбонизации поддерживают в пределах 0,1.0,2 мг-экв/л, при известково-содовом умягчении - 0,3.0,5 мг-экв/л.
При содово-натриевом методе умягчения воды ее обрабатывают содой и гидроксидом натрия:
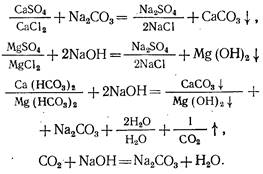
Ввиду того, что сода образуется при реакции гидроксида натрия с гидрокарбонатом, необходимая для добавки в воду доза ее значительно уменьшается. При высокой концентрации гидрокарбонатов в воде и низкой некарбонатной жесткости избыток соды может оставаться в умягченной воде. Поэтому этот метод применяют лишь с учетом соотношения между карбонатной и некарбонатной жесткостью.
Содово-натриевый метод обычно применяют для умягчения воды, карбонатная жесткость которой немного больше некарбонатной. Если карбонатная жесткость приблизительно равна некарбонатной, соду можно совсем не добавлять, поскольку необходимое ее количество для умягчения такой воды образуется в результате взаимодействия гидрокарбонатов с едким натром. Доза кальцинированной соды увеличивается по мере повышения некарбонатной жесткости воды.
Содорегенеративный метод, основанный на возобновлении соды в процессе умягчения, применяют при подготовке воды, для питания паровых котлов низкого давления
Са (НС03 ) 2 + Na2 C03 = СаС03 + 2NaHC03 .
Гидрокарбонат натрия, попадая в котел с умягченной водой, разлагается под влиянием высокой температуры
2NаHC03 = Na2 C03 + Н2 0 + С02 .
Образующаяся при этом сода вместе с избыточной, введенной вначале в водоумягчитель, тут же в котле гидролизует с образованием гидроксида натрия и оксида углерода (IV), который с продувочной водой поступает в водоумягчитель, где используется для удаления из умягчаемой воды гидрокарбонатов кальция и магния. Недостаток этого метода состоит в том, что образование значительного количества СО2 в процессе умягчения вызывает коррозию металла и повышение сухого остатка в котловой воде.
Бариевый метод умягчения воды применяют в сочетании с другими методами. Вначале вводят барий содержащие реагенты в воду (Ва (ОН) 2 , ВаСО3 , ВаА12 04 ) для устранения сульфатной жесткости, затем после осветления воды ее обрабатывают известью и содой для доумягчения. Химизм процесса описывается реакциями:
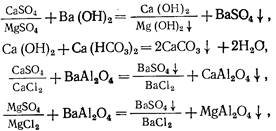
![]()
Из-за высокой стоимости реагентов бариевый метод применяют очень редко. Для подготовки питьевой воды из-за токсичности бариевых реагентов он непригоден. Образующийся сульфат бария осаждается очень медленно, поэтому необходимы отстойники или осветлители больших размеров. Для ввода ВаС03 следует использовать флокуляторы с механическими мешалками, поскольку ВаСО3 образует тяжелую, быстро осаждающуюся суспензию.
Необходимые дозы бариевых солей, мг/л, можно найти, пользуясь выражениями: гидроксида бария (продукт 100% -ной активности) Дб =1,8 (SO4 2- ), алюмината бария Дб =128Ж0 ; углекислого бария Дв = 2,07γ (S04 2- );
Углекислый барий применяют с известью. Путем воздействия углекислоты на карбонат бария получают бикарбонат бария, который и дозируют в умягчаемую воду. При этом дозу углекислоты, мг/л, определяют из выражения: Дуг. = 0,46 (SO4 2- ); где (S04 2- ) - содержание сульфатов в умягчаемой воде, мг/л; γ=1,15.1,20 - коэффициент, учитывающий потери углекислого бария.
Оксалатный метод умягчения воды основан на применении оксалата натрия и на малой растворимости в воде образующегося оксалата кальция (6,8 мг/л при 18° С)
![]()
Метод отличается простотой технологического и аппаратурного оформления, однако, из-за высокой стоимости реагента его применяют для умягчения небольших количеств воды.
Фосфатирование применяют для доумягчения воды. После реагентного умягчения известково-содовым методом неизбежно наличие остаточной жесткости (около 2 мг-экв/л), которую фосфатным доумягчением можно снизить до 0,02-0,03 мг-экв/л. Такая глубокая доочистка позволяет в некоторых случаях не прибегать к катионитовому водоумягчению.