Реферат: Основы минералогии
![]()
Соединения, состоящие из атомов трех элементов, называются тернарными; таковы различные кислородные соли.
![]()
Существуют, конечно, и соединения более сложного состава.
Химический состав химических соединений может изображаться двояким способом:
1) в виде эмпирических формул;
2) в виде конституционных или структурных формул.
Помимо бинарных и тернарных химических соединений, в природе распространены и более сложные соединения, например, двойные соли. Двойными солями называются такие соединения постоянного состава, которые состоят как бы из двух простых солей, присутствующих в кратных отношениях. В большинстве случаев эти соли являются двойными по катионам, реже — по анионам или одновременно по катионам и анионам. В качестве примеров могут быть приведены следующие:
![]()
3.2.2 Соединения переменного состава (твердые растворы, смешанные кристаллы, изоморфные смеси)
Кроме химических соединений постоянного состава, получаемых обычно в лабораториях с использованием чистых исходных компонентов, существует огромное множество таких соединений, состав которых не является постоянным, а колеблется то в узких, то в более широких пределах, причем эти колебания состава не могут быть объяснены наличием каких-либо механических примесей посторонних веществ. Наоборот, колеблющийся состав соединений с кристаллохимической точки зрения находит объяснение в растворимости составных компонентов в данном соединении.
Такие химические образования получили название соединений переменного состава.
Среди минералов соединения переменного состава составляют большинство. Существование веществ (фаз) переменного состава кажется вполне естественным, если речь идет о жидких растворах, состав которых определяется соотношением количеств растворенного вещества и растворителя. Таким образом, состав раствора колеблется в пределах от чистого растворителя до насыщенного раствора; он может быть любым из непрерывного множества возможных составов в пределах, зависящих от температуры и давления. Способность кристаллических веществ различного состава образовывать непрерывно меняющиеся по составу соединения одинаковой кристаллической структуры основана на изоморфизме, т. е. свойстве атомов различных элементов заменять друг друга в твердых химических соединениях.
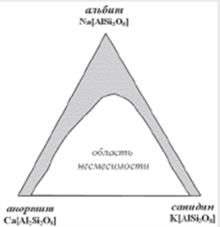
Системы с изоморфными замещениями могут быть и более чем двухкомпонентными. В случае таких систем речь уже идет не о рядах, а о полях и целых областях изоморфной смесимости, как это характерно, например, для полевых шпатов (рис. 2) при высоких температурах, когда смешению подвергаются плагиоклазы и калиевые полевые шпаты.
Ионные радиусы в вертикальных группах Периодической системы элементов возрастают с увеличением порядкового номера и уменьшаются в горизонтальном направлении с увеличением номера группы (т. е. с увеличением валентности). На этом основании А. Е. Ферсманом выведен закон диагональных рядов изоморфных ионов в Периодической системе элементов, справедливый для левой ее части. Намечаются следующие гетеровалентные ряды изоморфизма ионов (в скобках показаны ионные радиусы в ангстремах):
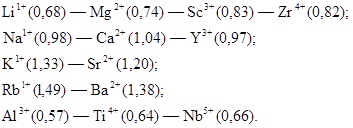
Действительно, в природных соединениях нередко наблюдаются, что литиевые минералы, например, содержат изоморфные примеси магния, магниевые минералы — примеси скандия, натриевые — примеси кальция, кальциевые — примеси иттрия и т. д.
3.2.3 Водные соединения
К числу водных соединений следует относить только такие, которые в своем составе содержат электрически нейтральные молекулы воды.
В зависимости от того, каким способом удерживается вода в минералах, различают:
1) кристаллизационную, или связанную, воду, входящую в кристаллические структуры минералов;
2) свободную воду, не участвующую в строении самого кристаллического вещества.
Связанная вода в кристаллической структуре участвует в виде молекул Н2О, занимающих в ней строго определенные места. Количество молекул воды находится в простых отношениях к другим компонентам соединения. В качестве примеров можно привести следующие: Na2CO3 . 10H2O (сода), Ca[SО4] . 2H2O (гипс), Ni3[AsO4]2 . 8H2O (аннабергит), Аl2[РО4](ОН)3 . 5Н2О (вавеллит)
![]()
Это так называемые кристаллогидраты, которые, по Вернеру, должны рассматриваться как "комплексные соединения", т. е. такие, в которых молекулы воды как структурные единицы располагаются в определенной координации вокруг каких-либо ионов, создавая таким путем своего рода комплексные ионы.
Свободная вода, присутствующая в минеральных массах, характеризуется тем, что не принимает прямого участия в строении кристаллического вещества минералов. При нагревании она выделяется постепенно.
Различают три вида свободной воды:
а) цеолитную;
б) коллоидную;
в) гигроскопическую.