Реферат: Озон
Як приємно прогулятися після грози! Повітря чисте й свіже, його струмені здається, без жодних зусиль проникають у легені. «Озоном пахне, — часто кажуть у таких випадках. —Дуже корисно для здоров'я» Чи це так? І взагалі, що ми знаємо про дивну речовину — озон, його властивості й застосування?
Уперше люди зустрілися з відчутними кількостями озону, коли були винайдені електростатичні машини на зразок тих, котрі можна побачити в шкільному кабінеті фізики. Так що вперше з цією речовиною познайомилися не хіміки, а фізики.
У 1785 році голландський фізик Мартін ван Марум одержав озон, піддаючи кисень дії електричних іскор, і навіть подумав, що знайшов особливу «електричну матерію».
Назву ж озону дав у 1840 році вже хімік, швейцарець Крістіан Шенбейн; він використовував грецьке слово ozon — «той, що пахне». Виявилося, що озон дійсно родич кисню, але значно більш агресивний. Так, він миттєво окиснює безбарвний калій йодид з виділенням бурого йоду:
2ʲ + 03 + Н2 О + І2 + 02 + 2КОН.
незабарв- бурий
лений
Навіть малоактивна при кімнатній температурі ртуть не може встояти під натиском цього газу — вона втрачає свій блиск і набуває здатності прилипати до скла. Окиснюється озоном і срібло:
8Ag + 2О2 → 4Ag2 0 + Ог
Озон і кисень — єдиний приклад утворення одним хімічним елементом двох газоподібних (за звичайних умов) простих речовин. Молекула кисню складається, як відомо, із двох атомів, а озону — із трьох, причому ці три атоми розташовані не на прямій лінії, а під кутом. Це є причиною ще однієї унікальної особливості цього газу — із усіх газоподібних речовин тільки молекули озону полярні, тобто являють собою діполь із розділеними в просторі зарядами.
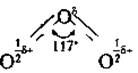
Шлях до отримання озону завжди однаковий — спочатку треба отримати вільні атоми Оксигену, наприклад, зруйнувавши молекулу кисню: О2 ↔ 20 - Q.
Потім кожен утворений атом Оксигену «прилипає» до молекули кисню з утворенням молекули озону:
О + 02 → О3 + Q.
Молекули кисню дуже міцні, для їхнього руйнування треба витратити дуже велику енергію — майже 500 кДж/моль, щоправда, при другій реакції частина її виділиться, так що для отримання 1 моль озону треба витратити 142 кДж енергії. Цю енергію простіше отримати фізичними методами — дією на кисень електричних розрядів, ультрафіолетових променів, гамма-квантів, електронів, тому, наприклад, озоном завжди пахне біля увімкнутих електричних машин, у яких «іскрять» щітки. Зараз озон найчастіше отримують дією на кисень так званим «тихим» (без іскор) електричним розрядом:
![]()
Але можливі й чисто хімічні способи отримання озону, щоправда, у дуже малих кількостях. Це відбувається при електролізі підкисленої води, при повільному окиснюванні на повітрі вологого білого фосфору, при розкладанні сполук із високим вмістом кисню (калій перманганату КМn04 , калій дихромату К2 Сг2 07 та ін.), при дії на воду фтору або на барій пероксид концентрованої сірчаної кислоти. Атоми Оксигену завжди присутні в полум'ї, тому якщо спрямувати струмінь стиснутого повітря поперек верхньої частини полум'я пальника, то з'явиться характерний запах озону. Зворотна реакція утворення кисню з озону відбувається з виділенням енергії, озон нестійкий.
Швидкість його розкладання значно збільшується в присутності каталізаторів (газів — нітроген оксидів, хлору; твердих речовин — металів, оксидів).
Які ж властивості чистого озону? Скраплюється він значно легше кисню, при температурі лише -111,9 °С (кисень — при -183 °С), а твердішає при-192,7 °С. Твердий озон синьо-чорний. Інтенсивність забарвлення рідкого озону настільки велика, що вже через дуже тонкий його шар не видно нитки палаючої електричної лампочки. Досліди з озоном небезпечні. Газоподібний озон здатен вибухати, якщо його концентрація в повітрі перевищує 9 %.
Озон відрізняється надзвичайно високою реактивною здатністю. Він найсильніший окиснювач, і в цьому відношенні поступається тільки фтору й оксиген фториду OF2 . Важлива відмінність озону від кисню в тому, що він виявляє окисні властивості вже при кімнатній температурі. Наприклад. PbS і Pb(OH)2 у звичайних умовах не реагують із киснем, тоді як у присутності озону сульфід перетворюється на PbSO4 , а гідроксид - на РbО
PbS + 20, → PbSO4 + O2
Pb(OH)2 + 2O3 → РbО + Н2 O + 3O2
Якщо в посуд з озоном налити концентрований розчин амоніаку, з'явиться білий дим — це озон окиснив амоніак з утворенням амоній нітриту NH4 N02
2NH3 Н2 О + О3 → NH4 NО2 + ЗН2 О
Особливо характерна для озону здатність «чорнити» срібні вироби з утворенням Ag2 0. Якщо спрямувати на поверхню твердого сухого лугу струмінь озону. то утвориться оранжево-червона кірка, що містить озон іди, наприклад
4КОН + 4О3 → 4КО3 + О3 ↑ + 2Н2 0
калій озонід
При цьому твердий луг ефективно зв'язує воду, що вберігає озонід від негативного гідролізу. Однак при надлишку води озоніди бурхливо розкладаються.
4КО3 + 2Н2 О → 4КОН + 5О2 ↑.
Розкладання озондів відбувається також за відсутності води — просто при зберіганні, наприклад
--> ЧИТАТЬ ПОЛНОСТЬЮ <--