Реферат: Простейшие бифункциональные природные соединения - мостик к массиву природных соединений
2. Оксокислоты
Оксокислоты в природе распространены значительно меньше, чем гидроксикислоты, они редко встречаются в свободном состоянии, не накапливаются в организмах, хотя и образуются на различных стадиях биосинтеза. По поводу последнего факта нужно отметить, что в биосинтезе они играют зачастую важнейшую роль, являясь ключевыми соединениями ряда биосинтезов.
Классифицируют оксокарбоновые кислоты, как и все бифункциональные соединения, согласно взаимному расположению функциональных групп, подразделяя их при этом на альдегидо- и кетонокислоты. Многие оксокислоты носят тривиальные названия.
В структурном плане оксокислоты несколько более примитивны, чем оксикислоты — сказывается потеря асимметрического центра при переходе от гидроксикислот к оксокислотам. Так, при окислении любой формы молочнойкислоты мы получим одну единственную пировиноградную кислоту. Но в тоже время, этот класс бифункциональных соединений отличается большим разнообразием химических реакций, химических особенностей, обязанных взаимному влиянию карбонильной и карбоксильной групп.
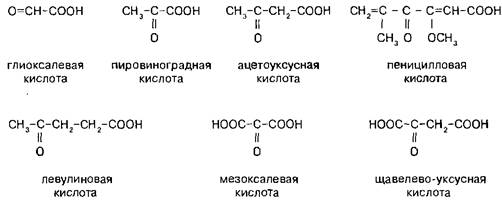
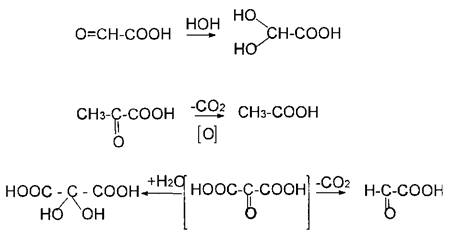
В случае б-оксокислот можно отметить легкость присоединения нуклео-фильных реагентов по карбонильной группе и легкость реакций декарбоксилирова-ния — пировиноградная кислота в условиях окислительного ферментатив-но катализируемого декарбоксилиро-вания образует уксусную кислоту. Мезоксалевая кислота сочетает в себе легкость протекания обоих этих процессов — она существует только в виде гидратированного аддукта и в водном растворе легко разлагается на глиоксалевую кислоту и двуокись углерода.
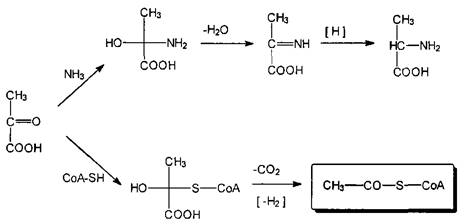
Пировиноградную кислоту следует выделить из всех б-оксокислот еще и как источник весьма существенных биологически активных соединений, получаемых invivoв результате реакции нуклеофильного присоединения по карбонильной группе и последующих преобразований. С таким реагентом как аммиак, она в несколько стадий, включая еще реакции дегидратации и восстановления, образует важную б-аминокислоту аланин; а при взаимодействии с тиолом ферментной природы, коферментом-А, через стадии присоединения, декарбоксили-рования и восстановления, образует ацетилированный кофермент-А — важнейший интермедиат многих биосинтетических реакций.
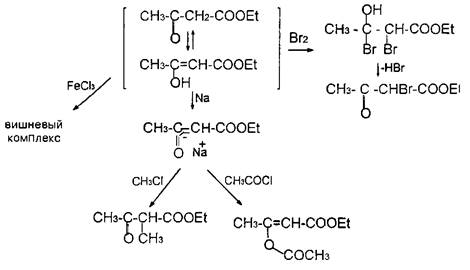
В случае в-кетокислот, на примере ацетоуксусного эфира, мы наблюдаем интереснейшее явление двойственной реакционной способности, называемое таутомерией. Применительно к указанному классу соединений, это явление названо кето-енольной таутомерией. Суть данного явления заключается в следующем: карбонильная и карбоксильная функции, будучи сильными электроноакцепторами, оголяют протоны метиленовой группы, расположенной между ними, что делает их кислыми. В силу этого водород в виде катиона может мигрировать к карбонильному кислороду несущему на себе избыточную электронную плотность; синхронно этому переходу электронная плотность карбонильной группы и у-связей метиленового фрагмента перераспределяется так, как это указано на схеме 2.2.4, образуя систему енола
Процесс является обратимым, поскольку гидроксил при тригональном углероде всегда достаточно кислый и его протон может осуществлять, в свою очередь, электрофильную атаку по С=С связи. Оба эти процесса совершаются столь медленно, что тау-томеры могут быть разделены либо кристаллизацией, либо фракционной перегонкой Но через некоторое время индивидуальные изомеры при стоянии снова превращаются в равновесную смесь соединений кетонной и енольной структуры Таким образом, ацетоуксусный эфир, кроме свойств кетонов и сложных эфиров, обнаруживает еще свойства непредельных соединений, спиртов и фенолов, так как гидроксил при двойной связи ведет себя так же, как и при ароматическом кольце
Следует отметить, что кето-енольная таутомерия проявляется и в свойствах вышеописанной пировинограднойкислоты, и хотя доля енольной формы у нее незначительна, в реакциях она реализуется часто как основная.

Для г- и д- оксокислот характерны как кето-енольная, так и кольчато-цеп-ная таутомерия. Результатом последней, в случае левулиновой кислоты, является гидроксилактон, наиболее устойчивая таутомерная форма этого соединения, которая достаточно легко отщепляет воду в присутствии водоот-нимающих агентов, образуя непредельные г-лактоны.
3. Аминоспирты
Алифатические соединения, содержащие амино- и гидрокси- группы, называемые аминоспиртами, классифицируют согласно взаимному расположению этих функциональных групп. 1,1-Аминоспирты— соединения достаточно нестабильные, не встречающиеся в природе, имеют значение как промежуточные в различных органических реакциях. Для химии природных соединений определенное значение имеют 1,2-аминоспирты, среди которых наибольшее значение имеет в-этаноламин, встречающийся достаточно часто в виде производных в связанном виде.
в-Этаноламин сочетает в себе свойства первичных спиртов и первичных аминов, обе эти группы в какой-то мере близки по своим свойствам: обе они выполняют электронодонорные функции, могут образовывать водородные связи, проявлять кислотные свойства, являются эффективными нуклеофила-ми. Присутствие и взаимное влияние этих двух функций внутри одной молекулы приводит к затруднению реакций, характерных для класса спиртов и класса аминов — в-этаноламины труднее дегидратируются, этерифицируются или Н-алкилируются. Те же реакции, которые реализуются, носят часто конкурентный характер. Так, при взаимодействии в-этаноламинов с минеральными кислотами может реализоваться как солеобразование по аминогруппе, так и нуклеофильное замещение спиртового гидроксила. При их реакции с карбоновыми кислотами возможно ацилирование обеих функциональных групп, то же самое возможно и при реакциях алкилирования.
Из приведенных на схеме 2.3.1 производных в-этаноламина следует отметить в первую очередь ацетилхолин, выполняющий в организмах теплокровных важнейшую функцию нейромеди-атора. Холин также далеко неэкзотичен в живой природе: он широко распространен в животных и растительных тканях, а также в микроорганизмах; особо высоко содержание его в нервной ткани мозга, печени, почек и мышцы сердца. Важное значение имеет также О-фосфат этаноламина, сочетающий в себе основнуюи кислотную функции и существующий в виде цвиттериона.

Этот цвиттерионный фрагмент — фрагмент, обладающий высокой гид-рофильностью — характерен для фос-фолипидов и соответственно липидных мембран. В некоторых биосинтетических реакциях, в частности, при биосинтезе некоторых аминокислот, в качестве донора метильных групп принимает участие бетаин.
Другой важной группой природных аминоспиртов являются сфингозины — составная часть сфинголипидов, выделенных впервые из тканей мозга, но впоследствии обнаруженных во многих животных и растительных источниках.
Производными в-аминоспиртов являются алкалоиды семейства эфедро-вых — эфедрин, норэфедрин, Н-метилэ-федрин. Среди них наиболее известен эфедрин, используемый в медицинской практике в качестве сосудосуживающего и бронхорасширяющего средства, его применяют при лечении аллергических заболеваний, а также как стимулятор центральной нервной системы и при отравлении некоторыминаркотиками, так как он является их антагонистом.



Из аминоспиртов растительного происхождения следует отметить мус-карин, содержащийся в мухоморе красном, являющийся имитатором ацетилхолина. В малых дозах он понижает у человека артериальное давление, амплитуду и частоту сердечных сокращений; в больших дозах вызывает спазмы мышц, судороги, коматозное состояние.
Аминоспирты животного происхождения представлены катехоламинами, осуществляющими регуляцию функций эндокринных желез и передачу нервных импульсов. В первом случае они рассматриваются как гормоны, во втором случае — как нейромедиаторы. Соединения этой группы, кроме спиртового гидроксила, имеют еще и фенольные функции. Биогенные катехоламины представлены тремя соединениями: дофамин, норадреналин, адреналин.
Роль этих веществ в жизнедеятельности животных важна и разнообразна. Дофамин стимулирует секрецию соматотропина и подавляет секрецию пролактина, он также регулирует уровень глюкозы в крови, диурез, кровоток в почках; нарушение синтеза дофамина в мозгу — причина возникновения болезни Паркинсона. Норадреналин участвует в передаче нервных импульсов, воздействует на мышцы кровеносных сосудов, сужая их и повышая тем самым артериальное давление. Адреналин также способствует сужению мелких кровеносных сосудов, вызывает усиление работы сердца, расслабляет мускулатуру бронхов и кишечника. При эмоциональных переживаниях, особенно в стрессовых ситуациях, усиленной мышечной работе, охлаждении и ф д. содержание адреналина в крови резко возрастает, что обеспечивает адаптацию организма к новым условиям.