Реферат: Процессы, механизмы и кинетические модели в синтетической химии
![]()
была открыта в МИТХТ им. Ломоносова в 1960 г. Реакция осуществляется в растворах солей PdCl2 -CuCl2 и Cu(OAc)2 в уксусной кислоте в присутствии NaOAc. Температура процесса 110 – 130о С и давление 3.0 – 4.0 МПа. Селективность по этилену – 83%. Кинетическое уравнение получено Моисеевым и Беловым в системе, не содержащей CuCl2
![]()
в предположении, что в условиях квадратичного торможения ацетатом натрия весь Pd(II) находится в форме комплекса Na2 Pd(OAc)4 . В работе П.Генри приведена другая форма уравнения в предположении, что активной формой Pd(II) является димер Na2 Pd2 (OAc)6 , концентрация которого проходит через максимум по [NaOAc]
![]()
Процесс синтеза винилацетата по реакции протекает в рамках механизма, аналогичного "Вакер"-процессу. Предполагается превращение p-комплекса Pd(II) в s-палладийорганическое соединение под действием OAc– из раствора, а распад полученного интермедиата включает стадию b-элиминирования ~PdH
![]() ,
,
где [Pd] – мономерный или димерный комплекс Pd(II). Окислением H-[Pd] и заканчивается каталитический цикл.
Фирмы Hoechst и др. разработали для реакции (15) гетерогенный катализатор, содержащий соли Pd(II), Au(III) и KOAc на Al2 O3 . Процесс протекает при 175 – 200 о С и давлении 0.5 – 1.0 МПа с высокой селективностью: 94% по этилену и 98% по уксусной кислоте. Состояние Pd(II) в условиях процесса и роль соединений золота пока не ясны.
Халкон-процесс. Эпоксидирование олефинов гидропероксидами осуществляется в промышленном варианте в растворах комплексов Mo(VI). В качестве ROOH используют 2-этилфенилгидропероксид (гидропероксид этилбензола, ГПЭБ), гидропероксид кумила (ГПК) и третбутилгидропероксид (ТБГП). В случае ГПЭБ сопряженно с пропиленоксидом получают стирол:
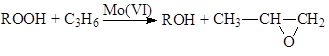
![]()
Скорость реакции описывается уравнением
![]()
где F Mo = 1 + K ГПЭБ [ГПЭБ] + K МФК [МФК] + K ОП [ОП] + K H 2 O [H2 O] есть закомплексованность катализатора, МФК – метилфенилкарбинол, ОП – пропиленоксид. Ki – константы равновесия образования соответствующих комплексов Mo. Как видно из уравнения, процесс протекает с лимитирующей стадией, переходное состояние которой включает ГПЭБ, Mo(VI) и пропилен. Показано, что активным катализатором является пропиленгликолятный комплекс Mo(VI), реакция которого с ГПЭБ и C3 H6 приводит к ОП.
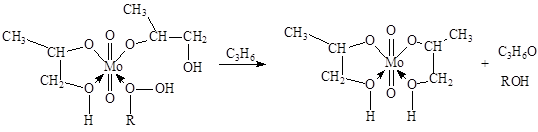
Окисление спиртов. Окисление (или окислительное дегидрирование) спиртов на металлических и окисных катализаторах до альдегидов и кетонов является важным промышленным процессом.
Рассмотрим подробнее процесс окисления метанола до формальдегида
![]()
В промышленности реализованы два варианты процесса окисления:
на оксидах MoO3 -Fe2 O3 (и др. оксидных катализаторах) процесс протекает в кинетической области при 300 – 350о С и 15-кратном избытке воздуха по отношению к метанолу. При этом достигаются 100% превращение спирта, высокая селективность и синтез безметанольного формальдегида, необходимого для процессов его полимеризации.
На серебряных катализаторах (мелкокристаллическое серебро, Ag/пемза, Ag/a-Al2 O3 и др.) процесс протекает в адиабатическом режиме в тонком слое катализатора (8 – 10 см) во внешнедиффузионной области. Количество подаваемого кислорода ~0.9 от стехиометрии.
И основная реакция, и побочная реакция
![]()
– экзотермические процессы. Эндотермический процесс дегидрирования, который имеет место в условиях процесса
![]()
не компенсируют большого количества выделяющегося тепла. Поэтому при низких температурах (220 – 250о С) процесс протекает в кинетическом режиме, однако при больших нагрузках по спирту и небольшом количестве воздуха процесс не удерживается в изотермическом режиме, и начинается быстрый подъем температуры, обусловленный плохим отводом тепла и повышением температуры зерна катализатора Тз. Повышение Тз вызывает экспоненциальный рост скорости, рост количества выделяющегося тепла qподв (ккал/(л·час)) и еще больший рост Тз, который останавливается в новом стационарном состоянии при высоком градиенте Тз – Tf (Tf – температура газа), обеспечивающем равенство отводимого и подводимого тепла qподв @ qотв. Таким образом:
в области низких температур Тз @ Tf, qподв @ qотв, процесс протекает в кинетической области (область i);
при повышении Тз возникает неустойчивый режим (область n);