Реферат: Процессы, механизмы и кинетические модели в синтетической химии
Окислительная димеризация алкинов (реакция Глязера-Залькинда) занимает важное место в синтетической химии.
![]()
В этой реакции, в отличие от Вакер-процесса, оба компонента каталитической системы Cu(I) и Cu(II) принимают участие в образовании продукта, а О2 (или другой окислитель, Q, Fe(CN)6 3– и т.д.) регенерирует необходимую для реакции форму Cu(II). Дегидроконденсацию алкинов можно провести в электрохимической системе (в анодной камере электролизера), например, по реакции
![]()
При использовании в качестве окислителя Cu(OAc)2 в Ру реакция является автокаталитической. В системе CuCl-CuCl2 -LiCl-H2 O при большом избытке LiCl (т.е. при постоянной концентрации Cl– ) скорость димеризации метилацетилена описывается уравнением
![]()
свидетельствующем о наличии лимитирующей стадии и аниона RCºC– в переходном состоянии лимитирующей стадии
[(RCºC–)·2Cu(I)·Cu(II)]≠
Таким образом, продукт превращения интермедиата RCºCCu·CuCl в реакции с CuCl2 (Х1) и является интермедиатом, участвующим в образовании диалкина. Предполагается следующая схема реакции:
![]()
![]()
![]()
![]()
Образование радикала RCºC· в стадии (с его последующей димеризацией) не проходит по термохимическим соображениям. В Мерокс-процесе стадия с участием RS· возможна. Похожая на реакцию димеризации HCN также осуществляется в растворах Cu(I)-Cu(II)
![]()
Гидролиз дициана дает оксамид NH2 COCONH2 – очень ценное удобрение.
Синтез оксида этилена. Этиленоксид (ЭО) получают по реакции
![]()
на серебряных катализаторах 15% Ag/a-Al2 O3 при 240 – 270о С и давлении 3МПа. При конверсии этилена < 10% селективность 80 – 85%. Побочная реакция – глубокое окисление этилена до СО2 . Селективность процесса повышают добавками Cl (NaCl) в катализатор или добавками дихлорэтана в сырье в количестве 2 – 10 ppm. СО2 образуется из С2 Н4 и при окислении ЭО, поэтому химизм процесса определяется совокупностью параллельно-последовательных реакций
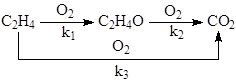
Обсуждаются различные гипотезы о механизме процесса, предполагающие образование СО2 на тех же центрах ZO2 , на которых образуется ЭО, или участие разных центров в образовании ЭО (ZO2 ) и СО2 (ZO). Скорость расходования О2 в области PC2 H4 > 0.9 атм на промотированном хлором катализаторе описывается уравнением первого порядка по РО2 (лимитирует адсорбция О2 ). При РО2 > 0.5 атм и PC2 H4 ≤ 0.02
![]()
Для очень простой схемы
![]()
![]()
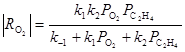
Из уравнения получаются оба частных случая. Процесс тормозится ЭО и СО2 , поэтому, например, при PC2 H4 > 0.9 атм в условиях первого порядка по РО2
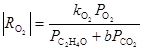
Если поверхностные соединения серебра и кислорода представить в виде химических соединений, то центрам Z, ZO2 и ZO можно сопоставить Ag2 O, Ag2 O3 и Ag2 O2 , соответственно. Имеются и другие представления об адсорбированных на поверхности серебра формах кислорода, в том числе и об участии в реакции атомов кислорода (или О– ), находящихся в приповерхностном слое.
--> ЧИТАТЬ ПОЛНОСТЬЮ <--