Реферат: Реальные рабочие тела – вода и водяной пар. Параметры и функции состояния водяного пара. Термодинамические процессы с водяным паром
Вода и водяной пар нашли широкое применение в качестве рабочих тел в паровых турбинах тепловых машин, атомных установках и в качестве теплоносителей в различного рада теплообменных аппаратах химико-технологических производств.
Газообразное тело, сосуществующее с кипящей жидкостью называется паром и значительно отличается по своим термодинамическим свойствам от свойств идеального газа.
Парообразованием называется процесс превращения вещества из жидкого состояния в парообразное.
Кипением называется процесс превращения жидкости, кипящей во всем её объеме, в пар при подводе к ней теплоты, а при отводе от пара теплоты происходит обратный процесс – конденсация.
Процессы кипения и конденсации протекают при постоянной температуре и при неизменном давлении, то есть tКП = tН.
Пар, соприкасающейся с жидкостью, из которой он получается и находящейся с ней в термодинамическом равновесии называется насыщенным.
Сухой насыщенный пар – пар, не содержащий в себе жидкость.
Влажным паром называется механическая смесь, состоящая из сухого пара и мельчайших капелек жидкости и характеризуется степенью сухости – Х или степенью влажности – (1 – Х).
Перегретым паром называется пар, полученный из сухого насыщенного пара при подводе к нему при P = Const некоторого количества теплоты и вызванного этим повышением его температуры. Разность между температурами перегретого пара – tП и сухого насыщенного – tН называется степенью перегрева.
До сих пор для реальных газов предложено много уравнений состояния. Однако все они относятся только к ограниченной области состояний. Для технически важных веществ, например, для водяного пара разработаны довольно точные уравнения, с помощью которых рассчитаны параметры и функции состояния в широкой области температур и давлений и сведены в таблицы и на их основе эти характеристики графически представлены в виде диаграмм в P – V, T – S и h – S координатах. Эти диаграммы дают возможность наглядно представить процессы и их энергетические особенности.
Фазовая P – V диаграмма системы, состоящей из жидкости и пара, представляет собой график зависимости удельных объемов кипящей воды – v' и сухого насыщенного пара – v" от давления (см. рис.1.1).
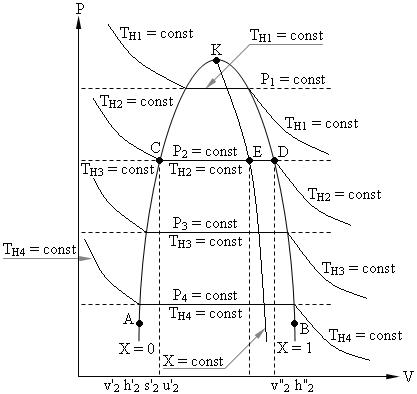
Рис. 1.1.
График зависимости v' = f(P) представлен на рис.8.1 кривой АК, которая называется нижней пограничной кривой или линией кипящей жидкости и характеризуется степенью сухости Х = 0.
График зависимости v" = f(P) представлен на рис.8.1 кривой ВК, которая называется верхней пограничной кривой или линией сухого насыщенного пара и характеризуется степенью сухости Х = 1.
Обе кривые АК и ВК делят P – Vдиаграмму на три части: влево от линии АК – область жидкости; между линиями АК и КВ – двухфазная система, состоящая из смеси кипящей воды и сухого пара – область влажного пара характеризуется степенью сухости 0 < X < 1; вправо от линии КВ и вверх от точки "K" располагается область перегретого пара.
Процесс парообразования в области влажного пара, линия CD, является одновременно изобарным (P = Const) и изотермическим (T = Const).
Обе кривые АК и КВ сливаются в точке К, которая называется критической точкой и характеризуется параметрами: РКР = 221,29 бар, tКР = 374,15 °C и vКР = 0,00326 м3/кг.
В критической точке исчезает различие между жидкостью и паром, выше её существование вещества в двухфазном состоянии невозможно.
Состояние воды и водяного пара аналогичным образом может быть представлено на T – S и h – S диаграммах (см. рис. 1.2).
T – S диаграмма широко используется при исследовании термодинамических процессов и циклов, так как позволяет видеть изменения температуры рабочего тела и находить количество тепла в процессе. Недостатком данной диаграммы является то, что при определении количества теплоты приходится измерять соответствующие площади.
Достоинством h – S диаграммы является то, что техническая работа и количество тепла в процессах, изображаются отрезками линий.
Решение задач, связанных с состоянием вещества, а также с термодинамическими процессами в области насыщенных и перегретых паров, можно производить или с помощью таблиц воды и водяного пара (см. таблицы № 5 – № 7, № 9 приложения), или с помощью h – S диаграммы. В этих задачах обычно определяются: начальные и конечные параметры пара, изменения внутренней энергии, энтальпии и энтропии, степень сухости, работа и количество теплоты.
Согласно объединённому уравнению первого и второго законов термодинамики:
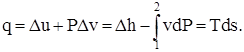 (1.1)
(1.1)
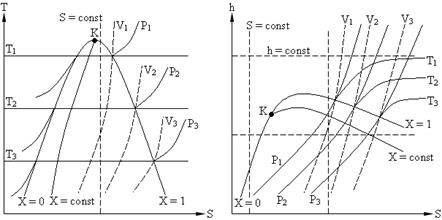
Рис. 1.2.
В расчетах состояний вещества и процессов в области влажного пара с помощью таблиц (см. таблицу №4 приложения) используются формулы вида:
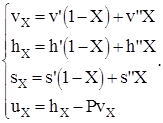 (1.2)
(1.2)
--> ЧИТАТЬ ПОЛНОСТЬЮ <--