Реферат: Роль опіоїдів у регуляції механізмів апоптозу при гострій серцевій недостатності в експеріменті
Отримані дані лише підтверджують етапність вивченого раніше механізму розвитку ГСН при застосуванні антрациклінових антибіотиків (утрата клітиною рідини й подальше “зморщення”), який заснований на інгібуванні синтезу нуклеїнових кислот, модифікації в транспорті сарколемального Са2+ , розвитку дисбалансу в електролітному складі (Minotti G., et al., 2004). Інтервал утрати структурованої внутрішньоклітинної води співпадав з початком максимальних проявів клітинної деградації, тому нами було виявлено, що показник фракції внутрішньоклітинної води (Ра) мав досить чіткий кореляційний зв'язок з відсотком фрагментації ДНК в тканині міокарда.
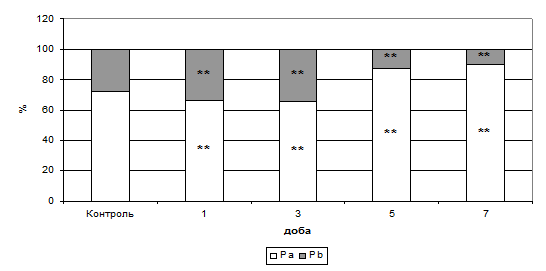
Рис. 7. Розподіл показників внутрішньо- (Ра) й позаклітинної (Рb) води в тканині міокарда при формуванні ГСН (%).
Примітки: ** - показники достовірні по відношенню до групи контролю (р<0,01).
На рис. 7 і 8 видно, що на тлі застосування даларгіну Т1-релаксація була достовірно вища за групу формування патології, а Т2 – мала тенденцію до зниження. Таке сполучення часових складових указує, що сигнал іде від кристалічної фракції води, тобто спостерігається її приріст. При цьому частка внутрішньоклітинної води на першу, третю й сьому добу мала тенденцію наближення до контрольних значень.
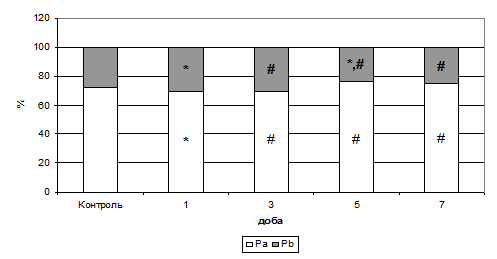
Рис. 8. Розподіл показників внутрішньо- (Pa) й позаклітинної (Pb) води в тканині міокарда при активації периферичних ОР на тлі формування ГСН (%).
Примітки: * - показники достовірні по відношенню до групи контролю (р<0,05);
# - показники достовірні по відношенню до групи ГСН (р<0,05).
У наших дослідженнях формування стану окисного стресу в міокарді супроводжувалося підвищенням експресії про- (р53) і зниженням експресії антиапоптотичних (Bcl-2) білків, що проявилося підвищенням рівня ф-ДНК кардіоміоцитів. Також спостерігався дисбаланс між захисними силами організму й пошкоджуючими факторами в бік останніх.
Дані, отримані в результаті вивчення розподілу й функцій ОР та опіоїдних пептидів, дозволяють пропонувати застосування цих препаратів з успішним результатом при ряді патологічних станів серцево-судинної системи. Встановлено, що ці ендогенні речовини можуть бути більш сильнодіючими, але викликати меншу кількість побічних ефектів, ніж звичайні фармакологічні засоби [GrossG.J., PeartJ.N., 2007].
Встановлені механізми пострецепторної дії ліганду ОР дозволяють говорити про участь у пошкодженні міокарда при гіперсекреції активних форм кисню таких посередників як NO й СФЗ. Стає зрозумілим, що гіперпродукція NO на даній моделі ГСН активувала процеси клітинної загибелі.
ВИСНОВКИ
1. Активація периферичних м- й д-опіатних рецепторів при антрацикліновій моделі стимуляції апоптозу міокарда супроводжується зниженням його проявів у кардіоміоцитах, активацією антиоксидантної системи й нормалізацією клітинного об’єму за участю системи оксиду азоту, сфінгомієлінового шляху, К+ АТФ -каналів.
2. Вивчено біохімічні ознаки активації апоптотичних процесів у серці на моделі формування гострої серцевої недостатності окисного ґенезу. Відмічено максимальне підвищення деградації ДНК (на 96,28 %) на третю добу спостереження. Встановлено, що за умов активації опіатних рецепторів морфологічні й біохімічні прояви апоптозу мали значно меншу вираженість у тканині міокарда (підвищення на 56,79 %).
3. Визначено, що початкова стадія гострої серцевої недостатності окисного генезу супроводжувалася максимальним підвищенням загального рівня оксиду азоту в тканині міокарда на третю добу (на 49,04 %). Перерозподіл стабільних метаболітів оксиду азоту в бік нітрит-аніонів при активації периферичних м- й д-опіатних рецепторів свідчить про можливу участь останніх у регуляції системи оксиду азоту.
4. Антиапоптотичний ефект синтетичного лей-енкефаліну – даларгіну – реалізується через активацію м- й д-опіатних рецепторів за участю К+ АТФ -каналів кардіоміоцитів за умов стимульованого апоптозу.
5. На тлі окисного стресу в міокарді як перша реакція спостерігається підвищення активності системи антиоксидантного захисту (у 4,6 рази) з подальшим її пригніченням. За умов активації периферичних опіатних рецепторів не спостерігалося зниження активності супероксиддисмутази протягом усього експерименту.
6. Встановлена активація сфінгомієлінового метаболічного шляху в міокарді при експериментальній гострій серцеві недостатності. Вона супроводжувалася прогресуючим підвищенням вільних сфінгоїдних основ (у 4,7 рази). Під впливом даларгіну цей показник значно знижувався (у 2,1 рази).
7. З першої по третю добу розвитку гострої серцевої недостатності в міокарді встановлені зниження часу релаксації й частки внутрішньоклітинної води кардіоміоцитів, які з третьої по сьому добу змінювались у бік гідратації клітин. При стимуляції апоптозу на цьому тлі через опіатні рецептори спостерігалося збільшення часу релаксації й зменшення внутрішньоклітинного об’єму, що обумовлено ущільненням гідратного шару тканинної води й вказує на нормалізацію клітинних процесів у міокарді.
СПИСОК ОПУБЛІКОВАНИХ РОБІТ
1. Андросова М.Е. Влияние даларгина на ЯМР-релаксацию сыворотки крови крыс при экспериментальной сердечной недостаточности // Український медичний альманах. – 2006. – Т. 9, № 2. – С. 11–12.
2. Комаревцева И.А., Андросова М.Е. Содержание фрагментированной ДНК в миокарде крыс при доксорубицин-индуцированной сердечной недостаточности и на фоне введения даларгина // Український медичний альманах. – 2006. – Т. 9, № 3. – С. 71–73.
3. Комаревцева И.А., Андросова М.Е. Уровень свободного сфингозина в миокарде при введении даларгина на фоне доксорубицин-индуцированной кардиомиопатии // Український медичний альманах. – 2006. – Т. 9, № 4. – С. 49–50.
4. Комаревцева И.А., Андросова М.Е. ЯМР-релаксация клеток миокарда крыс при стимуляции опиоидных рецепторов на модели сердечной недостаточности // Український медичний альманах. – 2006. – Т. 9, № 5. – С. 61–63.
5. Андросова М.Е. Стабильные метаболиты оксида азота при экспериментальной сердечной недостаточности на фоне активации опиатных рецепторов // Український журнал клінічної та лабораторної медицини – 2007. – Т. 2, № 1. – С. 61–65.
6. Комаревцева І.О., Андросова М.Є. Вплив активації периферичних опіатних рецепторів на вміст стабільних метаболітів оксиду азоту, вільного сфінгозину, оксидантно-антиоксидантний стан при експериментальному окисному стресі міокарда // Медична хімія. – 2007. – Т. 9, № 2. – С. 29–33.
7. Патент України на корисну модель. Спосіб підвищення толерантності кардіоміоцитів до доксорубіцин-індукованого оксидативного стресу / Комаревцева І.О., Андросова М.Є. – № 29411 від 10.01.2008, Бюл. № 1.
8. Патент України на корисну модель. Метод ранньої діагностики апоптотичних процесів у культурах клітин / Комаревцева І.О., Клімочкіна О.М., Орлова О.А., Андросова М.Є., Шипілова І.В., Бриндак Д.В. – № 25410 від 10.08.2007, Бюл. № 12.
9. Патент України на корисну модель. Спосіб визначення вмісту стабільних метаболітів оксиду азоту в культурі клітин / Комаревцева І.О., Клімочкіна О.М., Андросова М.Є., Шипілова І.В. – № 24577 від 10.07.2007, Бюл. №10.
10.Андросова М.Є., Денисенко А.С., Приходько А.С., Парінов Р.А. Апоптотична загибель кардіоміоцитів щурів під дією доксорубіцину // Перспективи розвитку фармацевтичної науки та практики в Україні: Тези I регіональної науково-практичної конференції молодих вчених і студентів. – Луганськ, 2005. – С. 41–42.