Реферат: Сера
1. Историческая справка.
2. Физические свойства.
3. Химические свойства.
4. Добыча серных руд и получение серы.
5. Применение серы.
Сера S – химический элемент VI группы переодической системы Мендеева, атомный номер 16, атомная масса 32,064. Твёрдое хрупкое вещество жёлтого цвета.
Историческая справка.
Сера в самородном состоянии, а также в виде соединений, например сульфидов, известна с древнейших времен. Жрецы использовали ее в составе «священных курений» при некоторых религиозных обрядах. Разные горючие смеси для военных целей также содержали серу. Еще у Гомера упоминаются «сернистые испарения» и смертельное действие продуктов горения серы. Она входила в состав «греческого огня», наводившего ужас на противников.
В 941 г. под стенами Царьграда был уничтожен флот киевского князя Игоря. В летописном своде событий «Повесть временных лет», составленном в Киеве, так описан поход Игоря: «Словно молнию... которая на небе, греки имеют у себя и пускали ее, сжигая нас, поэтому мы и не одолели их». Дружинники князя защищались от «греческого огня» щитами, воловьими шкурами, но потерпели поражение. Греки выбрасывали горящую смесь через медные трубы, установленные на бортах византийских кораблей. Состав этой смеси был неизвестен. Греки держали его в секрете. Предполагают, что в нее входили нефть, различные горючие масла, смола, селитра, клен, сера и вещества, которые окрашивали пламя.
Горючесть серы, легкость, с которой она соединяется с металлами, объясняют причину, почему ее считали «принципом горючести» и обязательной составной частью металлических руд. Наивное верование алхимиков о сере выражено в небольшом стихотворении Н. А. Михайловым:
Семь металлов создал свет. Медь, железо, серебро,
По числу семи планет: Злато, олово, свинец...
Дал нам Космос на добро Сын мой! сера им отец!..
В VIII—IX вв. в сочинениях арабских алхимиков рассматривается ртутно-серная теория состава металлов, согласно которой происхождение всех металлов объяснялось сочетанием серы и ртути. Эти воззрения сохранялись в Европе вплоть до XVIII в. Рождение металлов в средние века, конечно, мыслилось при благословении католической церкви, как это и изображено в иллюстрации к книге «Семь ключей мудрости», приписываемой алхимику Базилю Валентину.
Элементарную природу серы установил француз Антуан Лоран Лавуазье (по образованию юрист, а по призванию химик) в своих опытах по сжиганию.
Древнерусское название «сера» употребляется очень давно. По-видимому, оно происходит от санскритского слова «сира», что означает светло-желтый. Но есть и другое древнерусское название серы — «жупел» (сера горючая).
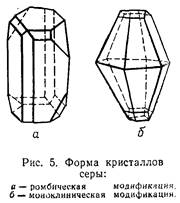
Сера —это порошок желтого цвета. Для нее характерно несколько модификаций, отличающихся друг от друга строением молекул и некоторыми свойствами. Так, ромбическая и моноклиническая сера всегда состоит из восьмиатомных кольцевидных молекул S8 .
|
Третья модификация серы пластическая. Она состоит из нерегулярно расположенных зигзагообразных цепочек Sn, где п достигает нескольких тысяч. Другие модификации серы построены из молекул S2 (пурпурная) и S6 (оранжево-желтая).
Сколько бы аллотропных видоизменений ни образовывал химический элемент, при определенных заданных условиях абсолютно устойчивым из них, как правило, оказывается лишь какое-то одно. Для серы самой устойчивой аллотропной модификацией при обычных условиях при нормальном давлении и температуре не выше 95,6°С является ромбическая сера. В нее при комнатной температуре (или близкой к комнатной) превращаются все другие формы. Например, при кристаллизации из расплава серы сначала получаются игольчатые кристаллы моноклинической формы, которые при температуре ниже 95,6°С переходят в ромбические. При температуре выше 95,6°С устойчива моноклиническая сера.
Подобные превращения происходят и с другими модификациями серы. Так, если расплавленную серу вылить в холодную воду, образуется эластичная, во многом похожая на резину коричневая масса. Переход из одной аллотропной формы в другую сопровождается поглощением теплоты:
S D S — Q кдж
кристал- пласти-
лическая ческая
Такую пластическую серу можно получить в условиях школьной лаборатории. Она неустойчива и через некоторое время станет хрупкой, приобретет желтый цвет, т. е. постепенно будет превращаться в ромбическую.
Физические свойства.
Плавление серы происходит в интервале температур 112—119,3°С (в зависимости от чистоты образца). При этом с увеличением температуры до 155°С вязкость расплава уменьшается и возрастает в тысячи раз в интервале температур 155—187°С. Затем снова наступает спад. На рисунке 10 показано, как изменяется вязкость расплава серы при нагревании. Имеется несколько объяснений этого явления. Одно из них таково, С возрастанием температуры от 155 до 187°С, вероятно, происходит значительный рост молекулярной массы. Кольцевые молекулы Ss разрушаются и образуются другие — в виде длинных цепей из нескольких тысяч атомов. Вязкость расплава увеличивается. При 187°С она достигает величины свыше 90 н • сек/м2 , т. е. почти как у твердого вещества. Дальнейшее повышение температуры ведет к разрыву цепей, и жидкость снова становится подвижной, вязкость
расплава уменьшается. При 300°С сера переходит в текучее состояние, а при 444,6°С закипает. В зависимости от температуры в ее парах обнаруживают молекулы S8 , S6 , S4 , S2 . При 1760°С пары серы одноатомны. Таким образом, с увеличением температуры число атомов в молекуле постепенно уменьшается:
S8 " S6 " S4 " S2 " S
Изменение состава молекул вызывает изменение окраски паров серы от оранжево-желтого до соломенно-желтого.
Сера в обычных условиях имеют различный цвет (см. выше). Окраска этих веществ обусловлена способностью поглощать какую-то часть спектра белого света. В результате этого они окрашены в какой-нибудь дополнительный (к цвету поглощения лучей) цвет. Дополнительными, или взаимокомпенсирующими, до белого цвета являются следующие пары цветовых сочетаний: красный — голубой, желтый — синий, зеленый — пурпурный и т. д. «Вычитание» какого-либо цвета из белого дает дополнительную окраску вещества. Так, ромбическая сера поглощает синий цвет, поэтому она окрашена в желтый, кристаллический моноклинный селен красного цвета, так как поглощает голубой.
Сера совершенно не проводит тока и при трении заряжается отрицательным электричеством, поэтому из нее делают круги электрических машин, в которых электрический заряд возбуждается посредством трения. Очень плохо проводит сера и тепло. Если в ней содержится менее 0,1% примесей, то при согревании куска серы в руке слышится своеобразный треск, и случается, что кусок распадается на части. Это происходит из-за напряжений, возникающих в куске вследствие его неравномерного расширения в связи с малой теплопроводностью серы.
Химические свойства.
Сера в обычных условиях с водородом не соединяется. Лишь при нагревании происходит обратимая реакция:
Н2 + S D H2 S + 20,92 кдж / моль
Равновесие ее при 350°С смещено вправо, а при более высокой температуре - влево.
Все элементы VI группы взаимодействуют с галогенами. Известны галогениды серы, селена и теллура и других элементов группы. Например, хлорид или бромид серы получают при нагревании серы с галогенами в запаянной трубке:
2S + Br2 = 83 Br2
2S+Cl2 = S2 Cl2
Хлорид серы S2 Cl2 является хорошим растворителем многих химических соединений серы. В частности, в химической промышленности его используют в качестве растворителя серы при вулканизации каучука.
--> ЧИТАТЬ ПОЛНОСТЬЮ <--