Реферат: Серная кислота
3-я стадия. Поглотительная башня:
nSO3 + H2 SO4 (конц) --> (H2 SO4 · nSO3 )(олеум)
Воду использовать нельзя из-за образования тумана. Применяют керамические насадки и принцип противотока.
Применение.
Помните! Серную кислоту нужно вливать малыми порциями в воду, а не на оборот. Иначе может произойти бурная химическая реакция, в результате которой человек может получить сильные ожоги.
Серная кислота — один из основных продуктов химической промышленности. Идет на производство минеральных удобрений (суперфосфат, сульфат аммония), различных кислот и солей, лекарственных и моющих средств, красителей, искусственных волокон, взрывчатых веществ. Применяется в металлургии (разложение руд, напр. урановых), для очистки нефтепродуктов, как осушитель и др.
Практически важно то обстоятельство, что очень крепкая (выше 75 %) серная кислота не действует на железо. Это позволяет хранить и перевозить её в стальных цистернах. Напротив, разбавленная H2 SO4 легко растворяет железо с выделением водорода. Окислительные свойства для неё вовсе не характерны.
Крепкая серная кислота энергично поглощает влагу и поэтому часто применяется для осушки газов. От многих органических веществ, содержащих в своём составе водород и кислород, она отнимает воду, что нередко используется в технике. С этим же (а также с окислительными свойствами крепкой H2 SO4 ) связано её разрушающее действие на растительные и животные ткани. Случайно попавшую при работе на кожу или платье серную кислоту следует тотчас же смыть большим количеством воды, затем смочить пострадавшее место разбавленным раствором аммиака и вновь промыть водой.
Молекулы чистой серной кислоты.
Рис.1. Схема водородных связей в кристалле H2 SO4 .
Молекулы, образующие кристалл моногидрата, (НО)2 SO2 соединены друг с другом довольно сильными (25 кДж/моль) водородными связями, как это схематически показано на рис. 1. Сама молекула (НО)2 SO2 имеет структуру искаженного тетраэдра с атомом серы около центра и характеризуется следующими параметрами: (d(S-ОН) = 154 пм, РНО-S-ОН = 104°, d(S=O) = 143 пм, РOSO = 119°. В ионе HOSO3 - , d(S-ОН) = 161 и d(SO) = 145 пм, а при переходе к иону SO4 2- тетраэдр приобретает правильную форму и параметры выравниваются [d(SO) = 148 пм].Кристаллогидраты серной кислоты.
Для серной кислоты известно несколько кристаллогидратов, состав которых показан на рис. 14. Из них наиболее бедный водой представляет собой соль оксония: H3 O+ HSO4 - . Так как рассматриваемая система очень склонна к переохлаждению, фактически наблюдаемые в ней температуры замерзания лежат гораздо ниже температур плавления.
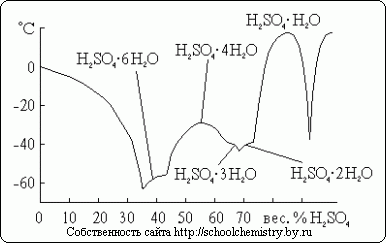
Рис. 14. Температуры плавления в системе H2 O·H2 SO4 .