Реферат: Силикаты и их использование
Содержание
Введение
1. Становление науки о силикатах
2. Кристаллохимическая систематика силикатов
3. Процессы образования силикатов в земной коре
4. Яркие представители группы силикатов
5. Применение и искусственное происхождение силикатов
Заключение
Список используемой литературы
Введение
Силикаты и алюмосиликаты представляют собой обширную группу минералов. Для них характерен сложный химический состав и изоморфные замещения одних элементов и комплексов элементов другими. Главными химическими элементами, входящими в состав силикатов, являются O, Si, Al, Fe2+ , Fe3+ , Mg, Mn, Ca, Na, K, а также Li, B, Be, Zr, Ti, F, H, в виде (OH)1- или H2 O и др.
Общее количество минеральных видов силикатов около 800. По распространённости на их долю приходится более 90% минералов литосферы. Силикаты и алюмосиликаты являются породообразующими минералами. Из них сложена основная масса горных пород: полевые шпаты, кварц, слюды, роговые обманки, пироксены, оливин и др. Самыми распространёнными являются минералы группы полевые шпаты и затем кварц, на долю которого приходится около 12% от всех минералов.
1. Становление науки о силикатах
Хотя история развития человеческого общества тесно переплетена с использованием силикатов как природного, так и искусственного происхождения, научный подход к изучению этих соединений сформировался относительно поздно – в конце XVIII – начале XIX столетия вместе со становлением химической науки. Это объясняется и специфическими особенностями силикатов: сложностью строения, вариациями химического состава, нерастворимостью и химической пассивностью, способностью к переходу в нестабильные состояния и высокой температурой плавления.
Первой научной теорией по систематике силикатов была так называемая поликремневая теория силикатов, которая на протяжении длительного времени (конец первой половины XIX ‑ 20-е годы XX века) играла важную роль в химии силикатов. Согласно этой теории, силикаты рассматривались как соли кремниевых кислот общей формулы nSiO2 " mH2O (n, m – целые числа). Значениям n > 1 соответствовали поликремневые кислоты. Простейшими представителями кремниевых кислот являются метакремневая H2SiO3 (n = 1, m = 1), ортокремневая Н4SiO4 (n = 1, m = 2), двуметакремневая H2Si2O5 (n = 2, m = 1), пирокремневая H6Si2O7 (n = 2, m = 3). Соли этих кислот получили названия мета-, двумета-, орто- и пиросиликатов соответственно. Для простых силикатов такие названия общеприняты и в настоящее время. Невозможность выделения кремниевых кислот в чистом виде из-за их коллоидного характера оставляла открытым вопрос о солеобразной природе силикатов. Более того, многообразие силикатов не укладывалось в рамки этой теории. Например, минералы жадеита NaAlSi2O6 и лейцита KAlSi2O6 относятся, казалось бы, к солям метакремниевой кислоты, но по своим свойствам сильно отличаются друг от друга. В приведенном случае поликремневая теория не смогла дать ответ о связи между химическим составом силикатных соединений и их строением, что является основной задачей любой систематики. Однако при формировании поликремневой теории была высказана гениальная догадка о полимеризации атомов кремния через атомы кислорода.
В своих трудах, посвященных природе силикатов, Д.И. Менделеев указывал на противоречия поликремневой теории. Он высказал идею об изоморфном замещении в силикатах не только оксидов одинакового типа, но и разных, таких, как SiO2 и Al2O3. Это наводило на мысль о сходстве и химических свойств этих оксидов. Далее на основании достаточно широкой вариации соотношения между основными и кислотными оксидами в силикатах Д.И. Менделеев отмечал, что нельзя объяснить все многообразие силикатов только существованием полимерных форм кремниевых кислот. По его мнению, силикаты представляют собой не соли, а «неопределенные соединения», такие, например, как сплавы, но не простых тел, а близких по своим свойствам оксидов. Д.И. Менделеев объяснял особенности силикатных «неопределенных соединений» не существованием различных видов поликремневых кислот, а полимеризацией большинства соединений кремния. Учение Д.И. Менделеева сыграло большую роль в дальнейшем понимании природы силикатов. В конце XIX века химические методы исследования (аналитические и синтетические) исчерпали свои возможности в познании силикатов. Исследователи начали искать новые пути решения проблем силикатов. Наиболее значительные результаты были достигнуты в физико-химическом и геохимическом направлениях.
Метод физико-химического анализа, созданный Н.С. Курнаковым в 20-е годы XX столетия, представляет собой синтез идей химической термодинамики и топологии. В рамках этого метода наиболее информативным оказалось рассмотрение диаграммы температура-состав (диаграмма состояния). Диаграммы состояния позволяют судить о температурно-концентрационных интервалах существования кристаллических и жидких силикатов, их превращениях (плавление, кристаллизация, разложение или соединение). Результаты многочисленных исследований диаграмм состояния (бинарных, тройных и более компонентных систем) обобщаются в соответствующих справочниках, в компьютерных банках данных, монографиях и учебных пособиях. Особенный интерес диаграммы состояния представляют для понимания процессов минералообразования, в материаловедении и технологии силикатов. В настоящее время использование термодинамического метода позволяет корректировать экспериментально полученные диаграммы состояния, предсказывать диаграммы состояния неизученных систем, судить о возможности протекания тех или иных процессов превращений силикатов, рассчитывать энергоемкость этих процессов, сравнивать устойчивость образовавшихся соединений по отношению к распаду на близлежащие по диаграмме состояния. Эти выводы делаются как на базе экспериментальных данных, так и с помощью разнообразных модельных представлений. В этой области автором и его сотрудниками получены интересные результаты, касающиеся устойчивости силикатных соединений, определения областей кристаллизации из расплавов тех или иных силикатов.
Видным представителем геохимического направления является В.И. Вернадский, который интересовался именно строением силикатов. Он создал свою теорию строения алюмосиликатов (1891–1937 годы). В.И. Вернадский так же, как и Д.И. Менделеев, говорил о близости химических функций SiO2 и Al2O3 и отвергал мысль о том, что алюмосиликаты есть соли кремниевых кислот. По его мнению, алюмосиликаты являются производными сложных алюмосиликатных радикалов, «каолиновых ядер». Гипотеза о «каолиновом ядре» как о замкнутой группировке атомов Si, Al и O оказалась актуальной при расшифровке структуры полевых шпатов.
2. Кристаллохимическая систематика силикатов
По хим. природе С. и в особенности С. сложного состава и строения (в т.ч. цементные гидросиликаты, цеолиты, С. с добавочными анионами и комплексными катионами) относятся к типичным гетеродесмич. соединениям, в к-рых реализуются одновременно разл. типы хим. связи-ионная, ковалентная, ионно-ковалентная, координационная, водородная и др. многоцентровые связи.
Структурная классификация С. базируется на рентгено-структурных расшифровках кристаллич. строения важнейших породообразующих силикатных минералов (преим. с мелкими катионами Be, Mg, Al, Zn, Fe, отчасти Na и К), выполненных начиная с кон. 20‑х гг. У. Брэггом, Л. Полин-гом, Нараи Сабо. В основу структурной систематики С. (Брэгг, Ф. Махачки) было положено строение анионных группировок-способ сочленения между собой элементарных звеньев-правильных кремнекислородных тетраэдров ![]() (рис. 1) в анионные радикалы конечных размеров или же в бесконечные одно-, двух- и трехмерные группировки. С 1950 в рентгеноструктурных исследованиях преим. школы Н.В. Белова были расшифрованы мн. кристаллич. структуры С. и их неорг. аналогов с крупными катионами Na, К, Са, Ва, РЗЭ и др. В основе систематики кремнекислородных группировок по Брэггу лежит размерное соответствие ребер тетраэдров SiO4 и октаэдров MgO6 . По Белову для кристаллохимии С. характерно стерич. соответствие ребра октаэдра СаО6 с расстоянием между вершинами диорто-группы
(рис. 1) в анионные радикалы конечных размеров или же в бесконечные одно-, двух- и трехмерные группировки. С 1950 в рентгеноструктурных исследованиях преим. школы Н.В. Белова были расшифрованы мн. кристаллич. структуры С. и их неорг. аналогов с крупными катионами Na, К, Са, Ва, РЗЭ и др. В основе систематики кремнекислородных группировок по Брэггу лежит размерное соответствие ребер тетраэдров SiO4 и октаэдров MgO6 . По Белову для кристаллохимии С. характерно стерич. соответствие ребра октаэдра СаО6 с расстоянием между вершинами диорто-группы![]() . Это наиб. наглядно иллюстрируется сочленением кремнекислородных цепочек с октаэдрич. колонками Са- и Mg‑октаэдров в структурах пироксена энстатита Mg2 (Si, O6 ), (рис. 2, а) и пироксеноида волластонита Са3 (Si3 O9 ), (рис. 2, б).
. Это наиб. наглядно иллюстрируется сочленением кремнекислородных цепочек с октаэдрич. колонками Са- и Mg‑октаэдров в структурах пироксена энстатита Mg2 (Si, O6 ), (рис. 2, а) и пироксеноида волластонита Са3 (Si3 O9 ), (рис. 2, б).
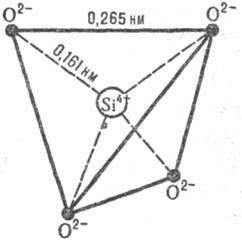
Рис. 1. Элементарный правильный кремне-кислородный тетраэдр SiO4 4-
Для кристаллохимии С. по Белову определяющим критерием конструирования или формирования типа кристаллич. структуры С. и их неорг. аналогов явился принцип «приспособляемости» кремнекислородных анионных группировок к существенно более крупным полиэдрам катионов. При классификации С. выделяют элементарное звено, участвующее в построении кремнекислород-ного![]() анионного каркаса, – орто-, диорто- и триортогруппы.
анионного каркаса, – орто-, диорто- и триортогруппы.

Рис. 2. Элементарные кремнекислородные единицы-ортогруппы![]() в структуре Mg‑пироксена энстатите (а) и диортогруппы
в структуре Mg‑пироксена энстатите (а) и диортогруппы![]() в Са-пироксеноиде волластоните (б).
в Са-пироксеноиде волластоните (б).
В целом С. могут быть подразделены на два класса: соединения с конечными размерами кремнекислородных группировок (островные структуры) и с бесконечными повторениями кремнекислородных тетраэдров при самых разл. способах их сочленения (полимерные, или конденсир., структуры). Причем анионный остов кристаллич. решетки, наряду с кремнекислородными анионами, может включать И дополнит. анионы-О2- , ОН- , Cl- , F- , ![]() ,
,![]() и нек-рые др.
и нек-рые др.
Островные С. делятся на соед. с одиночными кремнекислородными тетраэдрами – ортосиликаты (рис. 3, а) и со сдвоенными тетраэдрами – диортосиликаты (рис. 3, б). К таким С. относятся оливины (MgFe)2 SiO4 , циркон ZrSiO4 , гранаты ![]() , где МII = Mg, Ca, Fe(II), Mn(II), МIII = Al, Fe(III), Сr(III), V(III) и др. Соед. со сдвоенными тетраэдрами-минералы группы тортвейтита Sc2 Si2 O7 , ме-лилита и обширный класс пиросиликатов РЗЭ (рис. 3, б). По сравнению с орто- и диортосиликатами значительно менее распространены С. с открытыми линейными три- и тетраор-тогруппами, напр. киноит Cu2 Ca2 Si3 O10 ·2H2 O.
, где МII = Mg, Ca, Fe(II), Mn(II), МIII = Al, Fe(III), Сr(III), V(III) и др. Соед. со сдвоенными тетраэдрами-минералы группы тортвейтита Sc2 Si2 O7 , ме-лилита и обширный класс пиросиликатов РЗЭ (рис. 3, б). По сравнению с орто- и диортосиликатами значительно менее распространены С. с открытыми линейными три- и тетраор-тогруппами, напр. киноит Cu2 Ca2 Si3 O10 ·2H2 O.
Среди природных и искусственных С. широко распространены соед. с циклич. (замкнутыми) кремнекислородными группировками из трех-, четырех-, шестизвенных (рис. 3, в, г, д) и более сложных (восьми-, девяти-, двенадцатичленных) колец. К данной группе островных метасиликатов относится, напр., псевдоволластонит -Ca3 Si3 O9 (рис. 3, в). В берилле Ве3 Al2 Si6 O18 реализуется шестичленный кольцевой анион (рис. 3, д) с двумя мостиковыми Si‑О–Si связями, приходящимися на каждый тетраэдр, как и в др. циклич. анионах.
--> ЧИТАТЬ ПОЛНОСТЬЮ <--