Реферат: Синтез, перетворення та біологічна активність поліциклічних конденсованих систем на основі 4-тіазолідонів
- вивчити ліпофільність, провести докінгові дослідження та QSAR-аналіз групи потенційних протиракових агентів, на основі чого висунути гіпотезу про механізм дії та сформулювати рекомендації до раціонального дизайну «лікоподібних молекул».
Об’єктами дослідження були реакція гетеро-Дільса-Альдера у синтезі тіопірано[2,3-d]тіазолів, взаємодія 4-тіоксо-2-тіазолідонів (ізороданінів) з оксосполуками, реакції гетероциклізації, ацилювання, тіонування, алкілювання, рециклізації та «доміно»-процеси.
Предметом дослідження стали поліциклічні конденсовані системи з тіопірано[2,3-d]тіазольним фрагментом у молекулах, одержані на основі 4-тіазолідонів, як базові «структурні каркаси» для пошуку біологічно активних сполук.
Методи дослідження: органічний синтез, спектральні методи аналізу (ЯМР- та мас-спектроскопія), рентгеноструктурний аналіз, елементний аналіз, тонкошарова хроматографія, фармакологічний скринінг, QSAR-аналіз, докінгові дослідження.
Наукова новизна одержаних результатів. Реакцією гетеро-Дільса-Альдера синтезовано неописані в літературі 3,7-дитіа-5-азатетрацикло[9.2.1.02,10 .04,8 ]тетрадецени-4(8), 3,7-дитіа-5,14-діазапентацикло[9.5.1.02,10 .04,8 .012,16 ]гептадецени-4(8), а також тіопірано[2,3-d]тіазоли на основі акролеїну, ароїлакрилових кислот, диметилацетилендикарбоксилату та N-карбоксиметилмалеїніміду як дієнофілів. Встановлено, що при використанні 1,4-нафтохінону в реакції гетеро-Дільса-Альдера з 5-(R-метиліден)ізороданінами проходить спонтанна дегідрогенізація аддукту надлишком реагенту. Вперше доведено можливість синтетичної утилізації 5-алкіліденізороданінів як гетеродієнів. Встановлено, що взаємодія 5-етоксиметиліденізороданіну з ацетилендикарбоновою кислотою та її метиловим естром, ароїлакриловими кислотами і 1,4-нафтохіноном проходить із спонтанними перетвореннями [4+2]-аддукту, які включають не тільки встановлену раніше елімінацію молекули етанолу, а й декарбоксилювання та перегрупування подвійних зв’язків в залежності від природи дієнофілу. Запропоновано нову каскадну «доміно»-реакцію, яка полягає у взаємодії 5-(2-оксифенілметиліден)ізороданінів з акролеїном та поєднує гетеродієновий синтез і утворення циклічного напівацеталю. Показано, що взаємодія 2-(2,6-діоксо-3,5а,6,11b-тетрагідро-2Н,5Н-хромено[4',3':4,5]тіопірано[2,3-d]тіазол-5а-іл)оцтових кислот з амінопохідними в жорстких умовах проходить з рециклізацією у спірозаміщений піролідиндіоновий цикл і утворенням 7'-(2-гідроксифеніл)-3',7'-дигідро-2H,2'H,5H-спіро[піролідин-3,6'-тіопірано[2,3-d]тіазол]-2,2',5 -тріонів.Запропоновано метод синтезу амідів карбонових кислот з групи поліциклічних тіопірано[2,3-d]тіазолів з використанням N,N-дициклогексилкарбодііміду (DCC).
Проведено спрямований синтез 199 сполук, cеред яких ідентифіковано 32 речовини з високою протипухлинною, антиоксидантною, протигіпоксичною, протитуберкульозною, протисудомною, гастропротекторною та противірусною активностями. Протипухлинний та антиоксидантний ефекти тіопірано[2,3-d]тіазолів виявлено вперше, що свідчить про новизну та пріоритет дослідження. На основі вивчення ліпофільності сполук, COMPARE-аналізу, докінгу та QSAR-аналізу запропоновано рекомендації до раціонального дизайну потенційних протиракових агентів. Наукова новизна роботи підтверджена патентами України на корисну модель №7150 (2005 р.), №17608 (2007 р.), №17828 (2007 р.).
Практичне значення одержаних результатів. Розроблено методи синтезу та перетворень тіопірано[2,3-d]тіазолів. Виявлено нові високоактивні сполуки для поглиблених доклінічних досліджень. Встановлено кореляції «структура-активність» та сформульовано критерії для спрямованого синтезу і прогностичні характеристики для «лікоподібних молекул» з групи конденсованих похідних на основі 4-тіазолідонів. Фрагменти роботи впроваджено в науковий та навчально-методичний процеси Національного фармацевтичного університету (акти впровадження від 15.11.2006, 25.11.2006), а також включено у програму навчальної дисципліни «Комп’ютерні технології у фармації» (акт впровадження від 20.12.2007).
Особистий внесок здобувача. У ході виконання роботи автором реалізовано виконання експериментальної частини, узагальнення результатів та формулювання положень і висновків, які виносяться на захист. Співавторами наукових праць є науковий керівник, а також науковці, з якими проводились спільні фізико-хімічні та біологічні дослідження.
Апробація результатів дослідження. Основні положення дисертаційної роботи доповідались на VII Міжнародній конференції студентів медицини (Краків, Польща, 2003), XIX та XX Наукових з’їздах Польського фармацевтичного товариства (Вроцлав, 2004; Катовіце, 2007), VI Національному з’їзді фармацевтів України (Харків, 2005), Симпозіумі з хімічної біології нуклеїнових кислот (Оденсе, Данія, 2005), І Міжнародній науково-практичній конференції «Науково-технічний прогрес і оптимізація технологічних процесів створення лікарських препаратів», (Тернопіль, 2006), Міжнародній конференції «Органическая химия от Бутлерова и Бейльштейна до современности» (Санкт-Петербург, Росія, 2006), Міжнародній конференції «Хімія азотовмісних гетероциклів» ХАГ-2006 (Харків, 2006), Міжнародній науково-практичній конференції «Створення, виробництво, стандартизація, фармакоекономічні дослідження лікарських засобів та біологічно активних добавок» (Харків, 2006), Всеукраїнській науково-практичній конференції «Ліки-людині» (Харків, 2007), Всеукраїнській конференції «Домбровські хімічні читання» (Тернопіль, 2007), XI науковій конференції «Львівські хімічні читання» (Львів, 2007), Міжнародній науковій конференції «Bridges in Life Sciences» (Печ, Угорщина, 2007), засіданні кафедри фармацевтичної, органічної і біоорганічної хімії ЛНМУ ім. Данила Галицького (Львів, 2008).
Публікації. За результатами дисертації опубліковано 32 наукові роботи, з яких 6 статей - у наукових фахових виданнях, 5 статей - в іноземних фахових журналах та 21 тези доповідей. Одержано 3 патенти на корисну модель.
Структура та обсяг дисертації. Дисертаційна робота складається із переліку умовних скорочень, вступу, п’яти розділів, висновків, списку літератури та 3 додатків (3 c.). Загальний обсяг дисертації - 126 сторінок. Робота ілюстрована 48 таблицями (44 с.) і 11 рисунками (4 с.). Перелік використаної літератури містить 307 джерел.
ОСНОВНИЙ ЗМІСТ РОБОТИ
1.Cинтез нових поліциклічних систем з тіопірано[2,3-d]тіазольним каркасом на основі 5-ариліден- та гетериліден-4-тіоксо-2-тіазолідонів
З метою вивчення впливу «фіксування» біофорного 5-іліден-4-тіазолідонового фрагменту у конденсованих гетеросистемах на зміну фармакологічного профілю сполук та кореляцію «структура-активність» одержано нові похідні тіопірано[2,3-d]тіазолів за реакцією гетеро-Дільса-Альдера на основі 5-ариліден-4-тіоксо-2-тіазолідонів (5-ариліденізороданінів) як ключових гетеродієнів.
Використання акролеїну як дієнофіла (схема 1) дозволяє синтезувати 2-оксо-7-арил-3,5,6,7-тетрагідро-2Н-тіопірано[2,3-d]тіазол-6-карбальдегіди 2.1-2.4 та функціоналізувати тіопіранотіазолове ядро для наступних хімічних перетворень. Так, взаємодією 2.2 з тіосемікарбазидом одержано тіосемікарбазон 2.5, який у реакції [2+3]-циклоконденсації з N-(4-етоксикарбонілфеніл)малеїнімідом утворює похідне тіопірано[2,3-d]тіазолу з 4-тіазолідоновим фрагментом у боковому ланцюзі (2.6). Структура одержаних сполук підтверджена ПМР спектрами, причому КССВ (J = 4,5-4,7 Гц) дублету протону в положенні 7 (д = 4,23-4,27 м.ч.) вказує на його відносне транс-розташування до протону в положенні 6.
Схема 1
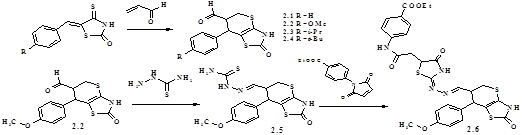
Рис. 1. Віднесення сигналів і кореляції НМВС сполуки 2.14.
Ряд нових функціоналізованих тіопірано[2,3-d]тіазол-2-онів 2.7-2.20 (схема 2) одержано при використанні як дієнофілів диметилацетилендикарбоксилату, ароїлакрилових кислот, а також N-карбоксиметилмалеїніміду, одержаного іn situ тривалим кип’ятінням малеїнового ангідриду і гліцину в оцтовій кислоті.
Схема 2
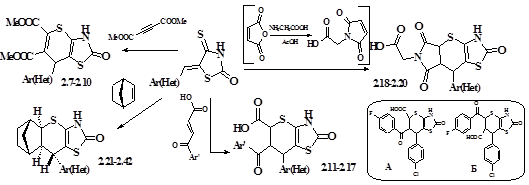
Рис.2. РСА сполуки 2.23
Перебіг [4+2]-цикло-приєднання ароїлакрилових кислот, а саме утворення продукту А (схема 2), підтверджено інтерпретацією гетероядерної кореляції спектрів 1 Н-13 С через один хімічний зв'язок (метод HMQC) та через 2-3 хімічних зв'язки (метод НМВС). За кореляціями аліфатичних протонів тіопіранового циклу з атомом карбону оксогрупи встановлено віднесення сигналів та кореляції НМВС на прикладі сполуки 2.14 (рис 1.). На основі спектрів ПМР сполук 2.11-2.17 за КССВ (J = 10,3 Гц) дублетів протонів 5-Н, 7-Н та триплету 6-Н протону (д = 3,28-4,67 м.ч.) можна констатувати взаємне цис-розташування усіх протонів водню, а для похідних 2.18-2.20 (д = 4,00-4,82 м.ч.) - цис-конфігурацію (J = 8,8 Гц) 5-Н і 6-Н та транс-розташування 6-Н і 7-Н протонів (J = 4,8 Гц).
Взаємодією 5-арил(гетерил)іденізороданінів з 2-норборненом одержано 9-Ar(Het)-3,7-дитіа-5-азатетрацикло[9.2.1.02,10 .04,8 ]тетрадецен-4(8)-они-6 2.21-2.42 (схема 2), стерео-конфігурація яких доведена рентгеноструктурним аналізом (РСА) сполуки 2.23 (рис 2).
На основі ангідриду 5-норборнен-2,3-дикарбонової кислоти синтезовано арил- (2.43-2.51) та бензиліміди (2.52-2.58), імідоалканкарбонові кислоти (2.59-2.65), їх естри (2.66-2.69) і аміди (2.70-2.85) та ариліденпохідні циклічного гідразиду (2.86, 2.87), які використані як дієнофіли в [4+2]-циклоконденсаціях (схеми 3, 8), а також для вивчення протисудомної активності. При взаємодії імідів з 5-арил(гетерил)іденізороданінами одержані 3,7-дитіа-5,14-діазапентацикло[9.5.1.02,10 .04,8 .012,16 ]гептадецени-4(8) 2.88-2.144. Враховуючи попередні дослідження стереоселективності аналогічної реакції з 2-норборненом та відому стерео-конфігурацію дієнофілів – N-заміщених біцикло[2.2.1]гепт-5-ен-2,3-дикарбоксімідів, можна зробити висновок про аналогічну структуру 2.88-2.144 (схема 3).
Схема 3

При дослідженні взаємодії 5-арил(гетерил)іден-4-тіоксо-2-тіазолідонів з 1,4-нафтохіноном очікувані продукти [4+2]-циклоприєднання зазнають спонтанної оксидації надлишком нафтохінону, що дозволило одержати ряд 11-заміщених 3,5,10,11-тетрагідро-2H-бензо[6,7]тіохромено[2,3-d]тіазол-2,5,10-тріонів 2.145-2.156, які містять у своїй структурі біофорні фрагменти протиракових лікарських засобів - адріаміцину, даунорубіцину, мітоксантрону та мітоміцину С (схема 4).
Схема 4