Реферат: Синтез, перетворення та біологічна активність поліциклічних конденсованих систем на основі 4-тіазолідонів
Підтвердженням проходження спонтанної дегідрогенізації є синглет протону у положенні 11 при 5,40-5,75 м.ч. у спектрах ПМР.
2. Синтез нових тіопірано[2,3 -d]тіазолів на основі 5-(цикло)алкіліден- та етоксиметиліден-4-тіоксо-2-тіазолідонів
Сучасні вимоги до нових біологічно-активних сполук обґрунтовують створення «лікоподібних молекул» з невисокою молекулярною масою (до 500). Тому з метою заміни арильних та гетерильних субституентів тіопірано[2,3-d]тіазолів на структурно простіші, як гетеродієни у реакції гетеро-Дільса-Альдера досліджено серію 5-алкілідензаміщених ізороданінів (схема 5). 5-Eтоксиметиліденізороданін 3.5 синтезовано за відомим методом (Ead, 1987), 5-(цикло)алкіліденізороданіни (3.1-3.4) одержано взаємодією ізороданіну з 10-15-кратним надлишком відповідного кетону при кімнатній температурі у присутності моноетаноламіну, а для синтезу 5-метоксикарбонілметиленізороданіну 3.6 використано тіонування його 4-оксоаналогу (Р.Б. Лесик, Б.С. Зіменковський, 2004).
Схема 5
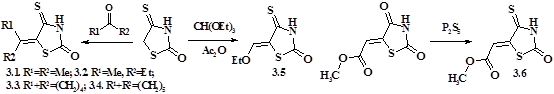
Нові 7-(цикло)алкілтіопірано[2,3-d]тіазол-2-они 3.7-3.22 одержані взаємодією 3.1-3.4, 3.6 з малеїнімідами, ароїлакриловими кислотами та 1,4-нафтохіноном (схема 6).
В спектрах ПМР сполук 3.7-3.14 та 3.19-3.21 протони груп СН у положеннях 5 і 6 тіопірано[2,3-d]тіазольного циклу проявляються двома дублетами при 3,07-5,38 м.ч. з КССВ J = 8,7-10,8 Гц, що свідчить про їх цис-розташування. Крім того, на основі ПМР- та хромато-мас-спектрів сполук 3.8 та 3.9 встановлено, що реакція гетеро-Дільса-Альдера 5-ізопропеніліденізороданіну 3.1 з малеїнімідами проходить з утворенням пари діастереомерів у співвідношенні ~1:1. Стереохімію наведеного процесуможна пояснити симетричністю іліденового фрагменту гетеродієну (2 метильні групи), а отже відсутністю переваги стосовно утворення (4aR,7aR)- чи (4aS,7aS)-аддуктів (схема 7).
5-(Цикло)алкіліденізороданіни 3.1, 3.2, 3.4 та 3.6 реагують з такими дієнофілами як 2-норборнен та іміди 5-норборнен-2,3-дикарбонової кислоти (схема 8), на відміну від 5-циклопентиліденізороданіну 3.3, що можна пояснити його низькою конформаційною гнучкістю, утрудненням наближення дієнофілу та утворення перехідного стану.
У реакції гетеро-Дільса-Альдера 5-етоксиметиліден-4-тіоксо-2-тіазолідону 3.5 з дієнофілами в середовищі оцтової кислоти утворений [4+2]-аддукт зазнає відщеплення молекули етанолу з утворенням додаткового ендоциклічного подвійного зв’язку, що підтверджується мас- та ПМР-спектрами (схема 9). Так, при взаємодії 3.5 з акролеїном та кротоновим альдегідом синтезовано гетероциклічні альдегіди 3.46 і 3.47, а використання як дієнофілів 2-норборнену та ряду норборненвмісних імідопохідних дозволило одержати тетра- (3.48) та пентациклічні (3.49-3.58) похідні 3,5-дигідротіопірано[2,3-d]тіазол-2-ону.
При взаємодії ацетилендикарбонової кислоти з 3.5 спостерігається не тільки елімінація молекули етанолу, а й декарбоксилювання інтермедіату з одночасним перегрупуванням системи кратних зв’язків з утворенням 2-оксо-2Н-тіопірано[2,3-d]тіазол-6-карбонової кислоти 3.60. На відміну від 3.60, приєднання диметилового естру ацетилендикарбонової кислоти відбувається лише з елімінацією етанолу та перегрупуванням системи спряжених подвійних зв’язків з утворенням сполуки 3.59. Реакція 3.5 з ароїлакриловими кислотами також супроводжується декарбоксилюванням [4+2]-аддуктів з утворенням сполук 3.61 та 3.62. Взаємодія 5-етоксиметиліден-4-тіоксо-2-тіазолідону з 1,4-нафтохіноном проходить з дегідруванням інтермедіату надлишком гідрохінону і утворенням додаткового ендоциклічного подвійного зв’язку та перегрупування системи спряжених подвійних зв’язків (3.63). Перебіг наведених реакцій підтверджено методами 1 Н-, 13 С-ЯМР та мас-спектроскопії. Процеси декарбоксилювання при одержанні 3.60-3.62 ймовірно можна пояснити утворенням водневого зв’язку в інтермедіаті і протонуванням атому сульфуру, що ініціює перенесення заряду та відщеплення діоксиду карбону (схема 10).
3. Синтетичні дослідження структурної модифікації похідних тіопірано[2,3 -d]тіазолів як можливих напрямків оптимізації «сполук-лідерів»
З метою вивчення можливих шляхів хімічної модифікації похідних 9,9-R1 ,R2 -3,7-дитіа-5-азатетрацикло[9.2.1.02,10 .04,8 ]тетрадецен-4(8)-онів-6, які проявили суттєву протиракову та антиоксидантну активності, опрацьовано реакції їх N-алкілювання через відповідні калійні солі.Як алкілюючі агенти для синтезу 4.1-4.7 використано етилхлорацетат та ряд N-арилхлорацетамідів. Гідразинолізом 4.7 одержано гідразид 4.8. З метою синтезу «біфармакофорних» молекул з фрагментом-носієм протипухлинної активності та тіазолідиндіоновим залишком, який повинен забезпечити афінітет до PPAR-г рецепторів, гідразид 4.8 проацильовано хлорангідридом 2,4-тіазолідиндіон-5-оцтової кислоти (4.9). Шляхом нуклеофільного приєднання фенілізотіоціанату (4.10) з наступною циклізацією у лужному середовищі фенілтіосемікарбазидного фрагменту одержано похідне 4.11 з 1-феніл-2-меркапто-1,3,4-тріазолільним фрагментом у молекулі (схема 11).
Схема 11
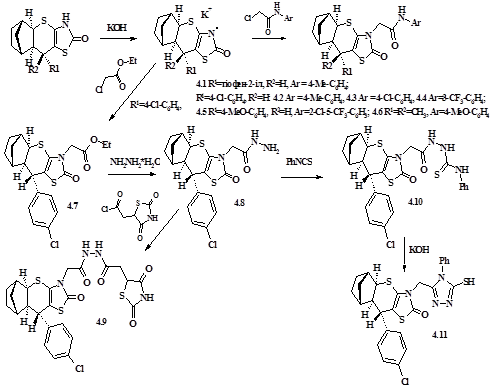
Відомо, що 5-(2-оксифенілметиліден)ізороданіни при взаємодії з похідними акрилової кислоти (Й.Д. Комариця, 1989; Kassab, 1976) та ангідридами дикарбонових кислот (Р.Б. Лесик, 2004) зазнають каскадної двоетапної реакції, яка проходить за «доміно»-механізмом, з утворенням оригінальних поліциклічних систем. Ми вперше встановили, що взаємодія акролеїну з 5-(2-оксифенілметиліден)ізороданінами проходить в аналогічній манері як тандемні реакції гетеро-Дільса-Альдера та утворення циклічних напівацеталів (4.14, 4.15), що інтерпретовано на основі мас- та 1 Н-ЯМР-спектрів (схема 12). Для хімічних перетворень в умовах «доміно»-реакцій ресинтезовано кислоти 4.12 та 4.13. Встановлено, що довготривале нагрівання сполуки 4.13 з ароматичними амінами та гліцином в середовищі оцтової кислоти призводить до неочікуваної рециклізації з розривом ендоциклічного естерного угрупування та утворенням спіро-заміщених сукцинімідів з тіопірано[2,3-d]тіазол-2-оновим фрагментом - 7'-(2-гідроксифеніл)-3',7'-дигідро-2H,2'H,5H-спіро[піролідин-3,6'-тіопірано[2,3-d]тіазол]-2,2',5-тріонів4.16-4.20. Використання традиційного методу одержання амідів 4.12, 4.13 через відповідні хлорангідриди не мало успіху, тому адаптовано альтернативний підхід ацилювання ароматичних амінів за допомогою N,N-дициклогексилкарбодііміду (DCC).
4. Біологічна активність нових поліциклічних конденсованих систем на основі 4-тіазолідонів
Реалізовані у роботі напрями фармакологічного скринінгу є фрагментами проекту, який базується на багаторічному досвіді наукової школи проф. М. Туркевича з корекцією на сучасні тенденції у світовій науці. Сумарні результати дослідження наведені у таблиці.
Таблиця
Загальні результати фармакологічного скринінгу
| Вид активності | Сполуки-кандидати | Сполуки з достатнім рівнем активності (%) |
| Протипухлинна активність | 59 | 11 (18,6%) |
| Антиоксидантна активність | 21 | 8 (38,0%) |
| Протигіпоксична активність | 15 | 2 (13,3%) |
| Протитуберкульозна активність | 62 | 6 (9,7%) |
| Протисудомна активність | 28 | 4 (14,3%) |
| Противірусна активність | 16 | 1 (6,3%) |
Прескринінг протиракової активності сполук (програма DTP, Національний Інститут Раку США (NCI), dr. V.L. Narayanan) проводився на 3 лініях ракових клітин: MCF7 (рак молочної залози), NCI-H460 (рак легень), SF-268 (рак ЦНС) у концентрації 10-4 М. Згідно з критеріями NCI до другого етапу досліджень відібрані сполуки 2.2, 2.7, 2.21-2.23, 2.136, 3.23, на фоні яких мітотична активність хоча б для однієї лінії ракових клітин не перевищує 33%. З 2006 року змінилась методологія прескринінгу, тому ряд сполук тестувались у концентрації 10-5 М на 60 лініях різних видів раку, причому для поглибленого in vitro скринінгу відібрано сполуки 2.150, 2.153 та 4.11. Для деяких сполук поглиблене дослідження протипухлинної активності проводилося без попереднього відбору.
Поглиблене дослідження in vitro полягало у тестуванні сполук у п’яти концентраціях при 10-кратному розведенні на 60 лініях людських ракових клітин, в тому числі лейкемії (6 ліній), недрібноклітинного раку легень (9 ліній), епітеліального раку (7 ліній), раку ЦНС (6 ліній), меланоми (7 ліній), раку яйників (6 ліній), нирок (8 ліній), простати (2 лінії) та молочної залози (7 ліній). Аналіз результатів протипухлинної активності дозволив виділити «сполуки-лідери» 2.22, 2.149, 2.150, 2.153, 4.3 та 4.11, для яких середнє значення lgGI50 <-4,80 (рис. 3), та встановити виразну селективність дії деяких речовин. Так, похідні 2.2, 2.10, 2.12, 2.21, 2.24, 2.32, 2.110, 4.3, 4.11 проявляють високу активність до клітинних ліній лейкемії , сполуки 2.150, 2.153, 3.23 – до меланоми, а 2.22 – раку молочної залози. Аналіз селективності дії до індивідуальних ліній пухлинних клітин дозволив відзначити високу чутливість клітинних ліній CCRF-CEM (лейкемія) до сполук 2.10 (lgGI50 =-6,11) та 2.110 (lgGI50 =-6,40), SR (лейкемія) - 2.32 (lgGI50 =-7,37), NCI/ADR-RES (рак молочної залози) - 2.22 (lgGI50 <-8,00), UACC-257 (меланома) - 2.153 (lgGI50 =-6,65).
Проведено COMPARE аналіз на рівні GI50 для активних сполук 2.21-2.42 з метою вивчення аналогії селективності дії до відомих протиракових агентів, які досліджувались у NCI. Встановлено кореляцію сполук 2.22 та 2.41 (PCC = 0,705ч0,838) зі стильбеновими аналогами NSC 645646, 638485 та 603443, які є інгібіторами полімеризації тубуліну, що дозволяє передбачити зазначений механізм протиракової дії для похідних з групи 2.21-2.42.
Докінгові дослідження (програмні пакети Glide та Fred) проведені до PPARг-рецептора (коди 1FM6 та 1NYX), білкового комплексу Bcl-XL -BH3 (1BXL) та тубуліну (1SA1), дозволили одержати ряд значень скорингових функцій, які оцінюють якість та енергію зв’язування лігандів з молекулою біомішені. QSAR-аналіз параметру протипухлинної активності lgGI50 (мультиваріативний регресійний аналіз методом часткових найменших квадратів, алгоритм «simulated annealing» для відбору змінних) з використанням значень скорингових функцій та 8 молекулярних дескрипторів (Mr, LogP, TPSA, HOMO та LUMO, m, qmin, та qmax ) для навчальної вибірки з сполук 2.21-2.23, 2.35-2.42 дозволив одержати достовірні QSAR моделі 1-4.
lgGI50 (Breast Cancer / T-47D) = 34,787*LUMO + 0,002*ZB(tubuline) (1)
(N=11, r2 =0,91, S=0,13, F=43, q2 =0,82)
lgGI50 (Breast Cancer / T-47D) = 35,259*LUMO – 0,015*PLP(1BLX) – 0,029*CS(1BLX) (2)
(N=11, r2 =0,93, S=0,11, F=33, q2 =0,88)
lgGI50 (Colon Cancer / HCT-116) = 0,611*m -2,294*qmin + 0,046*CS(1FM6) (3)
(N=10, r2 =0,93, S=0,07, F=32, q2 =0,81)
lgGI50 (CNS Cancer / SNB-19) = -0,388*LogP – 5,008*qmin – 0,035*PLP(1BLX) (4)
(N=11, r2 =0,91, S=0,09, F=24, q2 =0,81)
Одержані моделі вказують на найвищу кореляцію lgGI50 ліній раку молочної залози, простати та ЦНС з енергією найнижчої незайнятої молекулярної орбіталі (LUMO) та значеннями скорингових функцій докінгу до молекул тубуліну та білкового комплексу Bcl-XL -ВН3, які можна використовувати як основні потенційні мішені для дизайну сполук з протипухлинною активністю та віртуального скринінгу похідних тіопірано[2,3-d]тіазол-2-онів.