Реферат: Синтезы на основе СО и Н2
![]() (5)
(5)
![]()
При a < 1 и a¥ = 0
![]() (6)
(6)
![]() , (7)
, (7)
т.е. линейную зависимость ![]() от Р. В случае продуктов Фишера-Тропша уравнение (7) хорошо описывает эксперимент в интервале от Р (число атомов углерода) 4 до 11. При меньших значениях Р (С1, С2 и С3) и при Р ³ 13 наблюдаются отклонения от прямой, свидетельствующие об отличии механизмов образования С1 и С2 продуктов от механизма образования высших углеводородов. Значения a для кобальтовых катализаторов составляет 0.8 – 0.9.
от Р. В случае продуктов Фишера-Тропша уравнение (7) хорошо описывает эксперимент в интервале от Р (число атомов углерода) 4 до 11. При меньших значениях Р (С1, С2 и С3) и при Р ³ 13 наблюдаются отклонения от прямой, свидетельствующие об отличии механизмов образования С1 и С2 продуктов от механизма образования высших углеводородов. Значения a для кобальтовых катализаторов составляет 0.8 – 0.9.
Кинетически процесс ФТ очень сложен. Синтез углеводородов по ФТ – процесс многомаршрутный (обнаружено более 100 органических соединений в полученном жидком топливе). Процесс осложняется диффузией реагентов в поры катализатора через пленку углеводородов (восков). Поэтому основные кинетические модели для Fe и Co-катализаторов являются во многом эмпирическими и построены по скоростям убыли СО и Н2.
Рассматривают лишь первые стадии процессов. Так, на железном плавленом катализаторе в интервале 220 – 300оС и 15 – 50 атм обнаружено торможение процесса водой. Для лимитирующей стадии
![]()
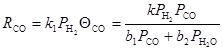 (8)
(8)
Уравнение (8) неплохо описывает скорость убыли СО на начальных стадиях процесса (Anderson, 1956 г). Уравнение, отличающееся от (8) зависимостью по ![]() , описано в работе Huff и Satterfield (1984 г)
, описано в работе Huff и Satterfield (1984 г)
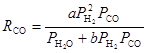 (9)
(9)
Предложены и другие как более простые, так и более сложные модели полуэмпирического типа для железных катализаторов. Например, интегральные уравнения для скорости убыли синтез-газа (плавленый железный катализатор, Eliott)
![]() , (10)
, (10)
где a – степень превращения синтез-газа, U – объемная скорость синтез-газа, час–1.
Уравнение, учитывающее конверсию СО и Н2О,
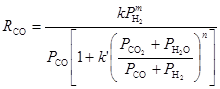 , (11)
, (11)
где m = 1 ¸ 2, n = 4 ¸ 7 – эмпирические параметры, зависящие от образца осажденного железного катализатора (Brütz и др.).
На Co-содержащем катализаторе (Co/CoO) эмпирические модели (12) и (13) не включают РН2О, но отражает сильное торможение по РСО
![]() (12)
(12)
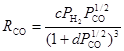 (13)
(13)
(Rautavuoma, van der Baan, 1981 г).
Недавно предложена модель на основе простого механизма, учитывающего образование поверхностного атома С(адс) из СО и стадии зарождения и роста углеводородной цепи, пригодное для железных и кобальтовых катализаторов (van Steen, Schulz, 1999 г). Скорость реакции рассчитывали как скорость образования углеродсодержащих соединений по количеству молей углерода, входящему в углеводородные продукты. Схема механизма включает квазиравновесные стадии на однородной поверхности
![]()
![]()
![]()
![]() ,
,
а также необратимые стадии превращения ZC
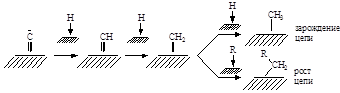
с лимитирующей первой стадией