Реферат: Синтезы на основе СО и Н2
и материальным балансом по катализатору
1 = QZ + QZC.
В результате получено уравнение (14), удовлетворительно описавшее экспериментальные результаты в широком диапазоне парциальных давлений для большого набора различных катализаторов (лучше, чем уравнения (9) и (13)):
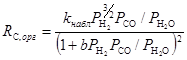 (14)
(14)
Теоретически обоснованные кинетические модели, вероятно, дело ближайшего будущего.
В настоящее время разработаны каталитические системы Co-цеолиты, Fe-цеолиты, которые позволяют получать бензиновые фракции с октановым числом ~80 и дизельное топливо с цетановым числом ~55 (цетан-100, гексадекан C16H34), что позволяет использовать искусственное жидкое топливо непосредственно после синтеза без дополнительной переработки. Топливо содержит небольшие количества ароматических углеводородов.
Реакцию ФТ проводят в реакторах стационарного слоя: Co, Shell, 1993 г; Fe-ARGE, Sasol, 1955 г. Недавно фирма Sasol (ЮАР) осуществила процесс в кипящем слое для синтеза С2 – С7 олефинов. Мощность установок 500000 т/г и 850000 т/г.
Интенсивно изучают барботажный процесс с диспергированным в масле кобальтовым или железным катализатором (Kölbel). Такой процесс называют slurry (тонкая взвесь) и рассматривают как наиболее эффективный путь к дизельному топливу.
Синтез метанола
Процесс синтеза метанола из СО и Н2 был разработан в 1923 г фирмой BASF на катализаторах ZnO-Cr2O3-Al2O3 (температуры 320 – 400оС, Р = 250 – 350 атм). В начале 70х были разработаны медноцинковые катализаторы низкого давления (ZnO-CuO-Al2O3), работающие при 230 – 280оС и 50 – 100 атмосферах синтез-газа. Процесс характеризуется высокой активностью и селективностью. При объемной скорости 10000 – 12000 час–1 на цинкхромовых контактах получается ~ 2кг метанола с 1л катализатора в час.
Стехиометрия процесса описывается реакцией (15)
![]()
![]() кДж/моль (15)
кДж/моль (15)
Вместе с тем исходная шихта, подаваемая в реактор, содержит 8 – 11% СО2, 16 – 21% СО и 67% Н2. Известно, что СО2 также подвергается гидрированию до метанола в условиях процесса
![]()
![]() кДж/моль (16)
кДж/моль (16)
однако синтез-газ (СО + Н2), не содержащий СО2 и воды, плохо превращается в метанол. Использование меченого 14СО2 и метода относительных селективностей (SCH3OH/SCO2) показало, что процесс на цинкмедных катализаторах протекает по схеме (Ю.Каган, Е.Сливинский, А.Розовский, 1975 – 1980 гг):
![]()
Если в системе есть вода, но нет СО2, протекают реакции
![]() (17)
(17)
![]() , (16)
, (16)
в которых вода выполняет роль катализатора. Если в системе есть СО2 (по СО2 наблюдается экстремум), протекают те же реакции
![]() (16)
(16)
![]() , (17)
, (17)
но в другом порядке и катализатором в отношении реакции (15) является СО2. Сухой газ (СО + Н2) без СО2 не превращается в метанол. На Fe-содержащем катализаторе возможен и прямой маршрут через СО.
Процесс синтеза метанола очень показателен в отношении развития кинетических моделей и представлений о механизме процесса.
Кинетические модели первого поколения исходили из представлений об однородной поверхности цинкхромового катализатора, и лимитирующей стадией считали взаимодействие адсорбированных молекул СО и Н2 (Д.Натта, 1953, I.Pasquon, 1960)
![]()
Для обратимого процесса с 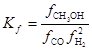 (fi – летучести) скорость описывали уравнением (18)
(fi – летучести) скорость описывали уравнением (18)
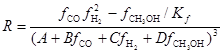 (18)
(18)
В начале 70х появились модели, учитывающие неоднородность поверхности катализатора(В.Леонов, 1973)