Реферат: Склокерамічні матеріали на основі компонента з фазовим переходом метал-напівпровідник
Різка зміна при ФПМН завдяки перебудові енергетичної структури електричних, оптичних магнітних та інших фізичних властивостей матеріалу має значний прикладний інтерес. Найбільш широко в науково-технічній літературі подано практичне використання діоксиду ванадію, який має температуру фазового переходу Tt ~ 341 К. Нещодавні дослідження показали, що ФПМН у нанокристалах VO2 відбувається за час менший, ніж 10-13 с. Це відкриває нові перспективи для створення на базі VO2 надшвидких оптичних і електричних перемикачів, використання яких, наприклад, в елементній базі обчислювальної техніки дозволить суттєво збільшити продуктивність комп’ютерів. Слід відмітити, що більшість відомих практичних використань пов’язано з плівками VO2 , які ведуть себе стабільно при термоциклюванні через температуру фазового переходу. Монокристали VO2 руйнуються при термоциклюванні. Це пов’язано з тим, що перебудова кристалічної гратки при ФПМН викликає значні механічні напруження в області межі металевої і напівпровідникової фаз, завдяки яким і малій пластичності монокристалів, відбувається їх розтріскування і руйнування. Так, наприклад, руйнування монокристалів V2 O3 і VO2 на окремі фрагменти відбувається вже після декількох термоциклів через температуру ФПМН.
Аналіз літературних даних показує, що систематичні дослідження фізичних процесів, які відбуваються в матеріалі при термоциклюванні через температуру ФПМН, практично не проводились, хоча такі дослідження є актуальними, тому що дозволяють отримати інформацію важливу як для розуміння механізму впливу термоциклювання на фізичні властивості матеріалу, так і для вирішення проблеми деградації об’ємних матеріалів з ФПМН. Такі матеріали, на відміну від плівок, здатні працювати при сильних електричних струмах, що має значний практичний інтерес для створення елементів силової електроніки. Об’ємні композиційні і керамічні матеріали на основі компонента з ФПМН у науковій літературі подані значно менше, ніж плівки. Як правило, для таких матеріалів не наводяться відомості про деградацію їх фізичних параметрів при термоциклюванні, а саме ця особливість є принциповою для практичного використання.
Перспективними для вирішення проблеми деградації об’ємних матеріалів з ФПМН є склокерамічні матеріали на основі компонента з фазовим переходом метал-напівпровідник. Такі матеріали можна отримати за керамічною технологією. Важливою вимогою до них, окрім стабільної поведінки при термоциклюванні, є забезпечення домінуючого внеску компонента з ФПМН в фізичні властивості матеріалу, інакше важливі для практичного використання ефекти, пов’язані з ФПМН, будуть втрачені.
Другий розділ присвячено базовим компонентам склокераміки на основі VO2 . В ньому описані розроблені в роботі наукові засади технології одержання VO2 методами електрокристалізації і відновлення V2 O5 вуглецем, результати дослідження електропровідності VO2 та ванадієво-фосфатних стекол, на підставі вивчення кристалізації ВФС побудована фазова діаграма системи V2 O5 -b-VOPO4 , наведені результати дослідження розчинення VO2 в розплаві V2 O5 і побудована модель розчинення VO2 в розплавах V2 O5 та стекол на його основі.
Електрокристалізацію VO2 (температура плавлення 1818 К) здійснювали при температурах 980 К – 1100 К шляхом пропускання електричного струму через розплав V2 O5 або ВФС. Кристали VO2 виростали на платиновому катоді і відокремлювались травленням у 30 % розчині KOH. Механізм електролітичного вирощування кристалів VO2 пов’язаний з реакцією термічної дисоціації V2 O5 «V2 O4 q + + Oq - і катодною електрохімічною реакцією V2 O5 + qe®V2 O4 + Oq - (q = 1 чи 2). Пропускання струму за рахунок катодної реакції веде до збагачення прикатодної області розплаву V2 O4 і, коли його вміст перевищує межу розчинності твердого діоксиду ванадію в розплаві, в прикатодній області створюються умови для росту кристалів VO2 із розчину в розплаві. Швидкість росту кристалів VO2 добре описується формулою, яка випливає з закону Фарадея:
![]() .(1)
.(1)
Вона складає ~ 2,53 мг/с при струмі 5 А (тут ko – число переносу іонів Oq - , kv – число переносу іонів V2 O4 q + , Mv – молярна маса VO2 , q – заряд іону кисню, NA – число Авогадро, I – сила електричного струму). Монокристали VO2 , вирощені методом електрокристалізації, мають форму голок з довжиною 5 – 15 мм і поперечним перетином 0,5 – 1,5 мм2 . В розплавах скла системи V2 O5 -P2 O5 оксид ванадію (V) грає вирішальну роль для електросинтезу кристалів VO2 , тому для їх вирощування найбільш придатні ВФС складів (мол. %) (10-20)P2 O5 –(90-80)V2 O5 .
При синтезі VO2 шляхом відновлення V2 O5 згідно реакції 2V2 O5 +C®4VO2 +CO2 потрібно забезпечити такий режим відновлення, який виключає утворення інших оксидів ванадію. Тому в роботі були досліджені різні режими відновлення, яке виконували в нейтральній газовій атмосфері гелію або аргону. Вміст іонів V4+ і V5+ у кінцевому продукті визначали методом окисно-відновлювального титрування, а для контролю фазового складу використовували рентгенофазовий і диференціальний термічний аналізи. За результатами досліджень запропоновано спосіб, що складається з наступних етапів: 1) приготування шихти із розрахунку 1 моль C на 2 моля V2 O5 ; 2) гомогенізація шихти та пресування з неї заготовок; 3) перший випал заготовок у нейтральній газовій атмосфері протягом 2,5 – 3 годин при температурі ~ 930 К; 4) подрібнення продукту першого випалу і пресування з нього заготовок; 5) повторний випал заготовок в нейтральній атмосфері протягом 1,5 – 2 годин при температурі, обраній в інтервалі 1170 К – 1220 К. Кінцевим продуктом методу є порошок з середнім розміром часток ~ 20 мкм і вмістом кристалічного VO2 не менше 98 ваг. %.
Питома електропровідність s, величина її стрибка при ФПМН і енергія активації s для VO2 , одержаного різними методами, наведені у табл. 1.
Таблиця 1
Електропровідність VO2 , одержаного різними методами
| Метод одержання VO2 |
s T=293 К Ом-1 м-1 |
s T=393К Ом-1 м-1 |
Величина стрибкаs при ФПМН | Енергія активаціїs, еВ | |
| T < Tt | T > Tt | ||||
| Електрокристалізація | 5,01 | 7580 | 680 | 0,19 | - |
| Відновлення V2 O5 вуглецем | 1,34 | 2500 | 400 | 0,21 | 0,08 |
На підставі дослідження кристалізації стекол системи V2 O5 -P2 O5 , з використанням методів рентгенофазового і диференціального термічного аналізів, встановлено, що при вмісті P2 O5 не більше 50 мол. % вони кристалізуються з виділенням фаз V2 O5 і b-VOPO4 . Побудована фазова діаграма системи V2 O5 -b-VOPO4 , яка має простий евтектичний тип з точкою евтектики ~ 60 мол. % V2 O5 . На підставі фазової діаграми системи V2 O5 -b-VOPO4 і результатів дослідження електрокристалізації VO2 в розплавах V2 O5 і ВФС, згідно яким вирішальну роль в процесі росту кристалів VO2 відіграє V2 O5 , обгрунтовано вибір скла (мол. %) 80V2 O5 –20P2 O5 для склокераміки на основі VO2 . Таке скло відповідає евтектиці в системі V2 O5 -b-VOPO4 і в його розплаві слід очікувати близько 60 мол. % V2 O5 .
Згідно загальним положенням теорії фізики спікання (Гегузін, Скороход), рідка фаза при рідкофазному спіканні керамічних матеріалів полегшує дифузійні процеси, які пов’язані з ростом кристалітів. В кераміці на основі VO2 і ВФС функцію рідкої фази при синтезі виконує розплав ВФС. Для з’ясування механізму взаємодії твердого VO2 з рідкою фазою в роботі були виконані дослідження кінетики розчинення VO2 у розплаві V2 O5 . Дослідження виконували при фіксованій температурі в повітряній газовій атмосфері над поверхньою розплаву. Діоксид ванадію, який після заданого часу витримки не розчинився в розплаві, виділяли травленням у 30 % розчині КОН. Реєстрували залежності від часу приросту маси системи „розплав -VO2 ” Dmo і маси розчиненого VO2 ![]() , яку визначали із вихідної маси VO2 та маси VO2 , який не розчинився. Такі залежності наведені на рис. 1. Інтенсивне розчинення VO2 на початковому етапі і його сповільнення із зростанням часу (рис. 1б) свідчить про насичення розплаву діоксидом ванадію. При достатньо великих проміжках часу швидкості розчинення VO2 і приросту маси системи „розплав-VO2 ” є постійними величинами, що залежать від висоти розплаву Lнад поверхнею VO2 . Це свідчить про те, що кінетика розчинення VO2 визначається процесом взаємодії розплаву з киснем повітря. З урахуванням результатів експерименту запропонована модель, в якій процес розчинення VO2 розглядається як перехід комплексів V2 O4 з твердої фази в розплав з подальшою їх дифузією до поверхні розплаву, де відбувається окислювальна реакція: V2 O4 +1/2O2 «V2 O5 .
, яку визначали із вихідної маси VO2 та маси VO2 , який не розчинився. Такі залежності наведені на рис. 1. Інтенсивне розчинення VO2 на початковому етапі і його сповільнення із зростанням часу (рис. 1б) свідчить про насичення розплаву діоксидом ванадію. При достатньо великих проміжках часу швидкості розчинення VO2 і приросту маси системи „розплав-VO2 ” є постійними величинами, що залежать від висоти розплаву Lнад поверхнею VO2 . Це свідчить про те, що кінетика розчинення VO2 визначається процесом взаємодії розплаву з киснем повітря. З урахуванням результатів експерименту запропонована модель, в якій процес розчинення VO2 розглядається як перехід комплексів V2 O4 з твердої фази в розплав з подальшою їх дифузією до поверхні розплаву, де відбувається окислювальна реакція: V2 O4 +1/2O2 «V2 O5 .
Розв’язування системи рівнянь, які описують дифузію комплексів V2 O4 в розплаві, кінетику їх переходу з VO2 в розплав і окислення на його поверхні дає наступні вирази для швидкості розчинення VO2 і приросту маси системи:
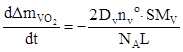 , (2)
, (2)
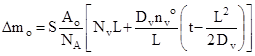 , (3)
, (3)
де t- час, Dv і Nv – коефіцієнт дифузії і вихідна концентрація комплексів V2 O4 в розплаві; nv o – концентрація комплексів V2 O4 , що відповідає границі розчинності VO2 ; NА – число Авогадро; Mv - молярна маса VO2 ; S – площа стикання розплаву з поверхнею VO2 ; Ao – атомна маса кисню.
Зворотно пропорційна залежність швидкостей Dmo /Dt, ![]() від висоти розплаву L добре виконується на практиці, що засвідчує адекватність моделі експерименту. В межах моделі отримані співвідношення, які дозволяють визначити низку параметрів процесу розчинення VO2 в розплаві V2 O5 . Такі параметри наведені в табл. 2.
від висоти розплаву L добре виконується на практиці, що засвідчує адекватність моделі експерименту. В межах моделі отримані співвідношення, які дозволяють визначити низку параметрів процесу розчинення VO2 в розплаві V2 O5 . Такі параметри наведені в табл. 2.
Процес дифузії V2 O4 в розплавах V2 O5 і ВФС можна розглядати як естафетний обмін киснем між комплексами V2 O4 і V2 O5 , котрі співіснують в таких розплавах. Тоді процес розчинення VO2 в розплавах, які містять V2 O5 , можна схематично описати реакціями:
V2 O4 (т) + V2 O5 (р) «V2 O5 (т) + V2 O4 (р); V2 O5 (т) ®V2 O5 (р),
де (т) і (р) відповідають твердій і рідкій фазам. Оскільки температура перевищує температуру плавлення V2 O5 , V2 O5 (т), який утворюється на поверхні твердого VO2 , переходить до розплаву, на що вказує друга з наведених вище реакцій.