Реферат: Соединения, изолируемые перегонкой с водяным паром: кетоны - ацетон
1. Свойства и применение ацетона
Ацетон
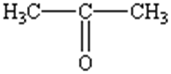
Синонимы: Диметилкетон, 2-пропанон
1.1 Свойства
Ацетон – это бесцветная горючая жидкость с характерным запахом. Смешивается со спиртом, эфиром и водой в любых соотношениях. Не образует азеотропной смеси с водой. Из водных растворов ацетон высаливается хлоридом натрия, хлоридом кальция, карбонатом калия (жидкость разделяется на два слоя). Ацетон хорошо растворяет соли многих неорганических кислот и ряд органических соединений. Ацетон получают при сухой перегонке дерева, каменного угля, а также путем синтеза. 3-й класс опасности, хорошо смешивается с водой и спиртом, смесь ацетона и воздуха взрывоопасна.
Таблица 1.1 Свойства ацетона
| Молекулярный вес | 58,08 |
| Температура плавления | -95,35 0 С |
| Температура кипения | 56,24 0 С |
| Температура вспышки | -18 °С |
| Температура самовоспламенения | 500 °С |
| Температурные пределы воспламенения паров в воздухе |
нижний – -20 °С верхний – 6 °С |
| Концентрационные пределы воспламенения паров в воздухе |
нижний – 2,2% (по объему) верхний – 13% (по объему) |
| Минимальная энергия зажигания паров в воздухе | 0,6 мДж |
| Плотность | 0,79 г./см3 |
| Дипольный момент при 2 Дебай | 2,72 |
| Вязкость, сантипуазы при 15 С | -0,3371 |
| Поверхностное натяжениепри 20 С | : 23,32 дины на сантиметр |
| Показатель преломления | 1,358825 |
Ацетон обладает всеми химическими св-вами, характерными для алифатических кетонов. Он образует кристаллические соединения с гидросульфитами щелочных металлов, например с гидросульфитом натрия – (CH3 )2 C(OH) SO3 Na.
Только сильные окислители, например щелочной раствор калия перманганата и хромовая кислота, окисляют ацетон до уксусной и муравьиной кислот и далее – до СО2 и воды.
Каталитически ацетон восстанавливается до изопропанола, амальгамамы Mg или Zn, а также цинком с уксусной кислотой – до пинакона.
Атомы водорода в ацетоне легко замещаются при галогенировании, нитрозировании и т.п. Действием хлора и щелочи (напр. натрия гидроксидом) ацетон превращается в хлороформ, который взаимодействует с ацетоном с образованием хлорэтона, применяемого как антисептик.
Ацетон окисляет вторичные спирты в присут. алкоголятов Аl до кетонов.
Ацетон вступает в альдольную конденсацию с образованием диацетонового спирта, а также в кротоновую конденсацию с образованием окиси мезитила (СН3 )2 С=СНСОСН3 , форона (СН3 )2 С=-СНСОСН=С(СН3 )2 и мезитиленацетона.
В присутствии сильной минеральной кислоты (например серная кислота) ацетон алкилирует фенол с образованием дифенилолпропана (бисфенола ацетона) (НОС6 Н4 )2 С(СН3)2 , присоединяет цианид- ион с образованием ацетонциангидрина (CH3)2 C(OH) CN.
При пиролизе (700 °С) ацетона образуются кетен СН2 =С=О и метан.
1.2 Применение
В промышленности ацетон получают преимущественно так называемым кумольным способом одновременно с фенолом из бензола и пропилена через изопропилбензол (кумол) по схеме:
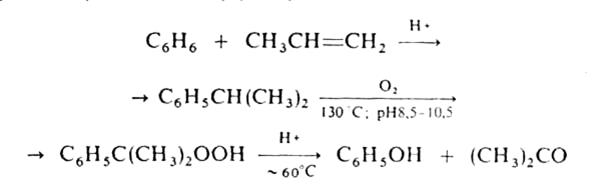
В ряде других промышленных способов синтеза ацетон исходят из изопропанола:
1. Окисление в паровой фазе (катализатор – металлический Cu, Ag, Ni или Pt):
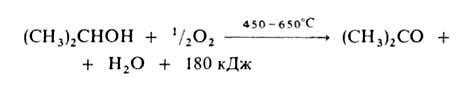
Высокий выход ацетона (≈90%) достигается при использовании Ag, осажденного на пемзе, или серебряной сетке.
2. Автокаталитическое окисление в жидкой фазе при 90–140 °С и 0,2–0,3 МПа:
![]()
Выход ацетона 95% от теоретического, Н2 О2 87%.
--> ЧИТАТЬ ПОЛНОСТЬЮ <--