Реферат: Современное содержание термина "активация"
Примеры: K2 [PtCl6 ], [Co(NH3 )3 (NO2 )3 ] , K3 [Co(NO2 )6 ]– моноядерные комплексы;
Pt4 (OCOCH3 )8 – тетраядерный (полиядерный) комплекс.
2. Комплексы могут быть нейтральными, анионными или катионными.
Примеры: K2 [PtCl6 ] –анионный комплекс,
[Co(NH3 )3 (NO2 )3 ] – нейтральный комплекс
[Co(NH3 )6 ]Cl2 .- катионный комплекс.
3. Комплексы можно классифицировать по координационному числу КЧ (т.е. количеству координированных лигандов). КЧ бывают равными 1,2,3,4,5,6,7,8 и9.
Для моноядерных соединений наиболее часто встречаются КЧ 4 и 6.
4. Комплексы можно классифицировать по координационному полиэдру.
Координационный полиэдр – это геометрическая фигура, которая образуется после соединения прямыми линиями всех лигандов (их первых атомов). В центре такой фигуры располагается ион металла. Для моноядерных соединений характерны полиэдры в виде плоского квадрата, тетраэдра и октаэдра.
Примеры:
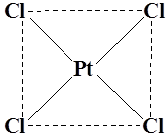
K2 [PtCl4 ] (плоскийквадрат)
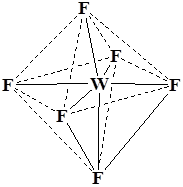
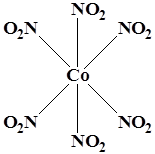
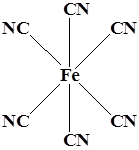
WF6 K3 [Co(NO2 )6 ] K3 [Fe(CN)6 ]
Октаэдр
3. Комплексы можно классифицировать, исходя из химической природы лигандов.
.
Координационная емкость лигандов (или дентатность) – это число координационных мест, которое занимает у центрального атома данный лиганд.
Примеры: монодентатные лиганды – аммиак, галогены, халькогены, и т.д.
Полидентатные лиганды – с.22 и далее
Бидентатные: карбонат, оксалат, этилендиамин
Тридентатные: диэтилентриамин
Тетрадентатные: этилендиаминтетрауксусная кислота .
Полидентатные лиганды, содержащие электронодонорные функциональные группы различного типа –кислотные и основные – называют комплексонами.
Пример: соль Цейзе – атомы этилена расположены на одинаковом расстоянии от атома платины и координационную емкость этилена можно было бы считать равной 2. Однако координационная емкость лиганда определяется числом монодентатных лигандов, которые могут заместить данный лиганд или которые замещаются данным лигандом. Поэтому для этилена КЕ = 1.
Классификация комплексов по химической специфике лигандов
1. Атомы элементов в качестве лигандов (H, O, N, C, S, Se, F, Cl и др.). Некоторые из них – координируются в виде одно- или двухзарядных анионов, другие не существуют в индивидуальном состоянии в мягких условиях (N, O, S).
ПРИМЕРЫ КОМПЛЕКСОВ
А) гидридные комплексы (например, гидриды рения). В комплексе рения [ReH9 ]2- шесть атомов водорода находятся в вершинах тригональной призмы, а три атома водорода образуют правильный треугольник, лежащий на одинаковых расстояниях от обоих оснований призмы. Металл-комплексообразователь находится в центре этого треугольника.
б) галогенидные комплексы: