Реферат: Строение вещества
угловая часть лапласиана - оператор Лежандра: ![]()
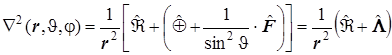 .
.
Оператор Лежандра с точностью до постоянного множителя совпадает с оператором квадрата момента импульса, а именно ![]()
Уравнения Лапласа и Лежандра для шаровой системы (очень полезная информация):
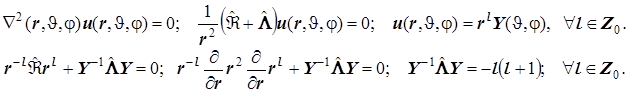
Отсюда - правило квантования модуля момента импульса при сферическом вращении.
Квантование модуля и проекций момента импульса при пространственном вращении
![]()
Вращательные соcтояния {s, p, d, f,... } Ûl={0,1,2,3}. Углы прецессии момента импульса.
Уравнение Шрёдингера для одноэлектронного атома (водородоподобного иона). Разделение переменных и квантование динамических величин:
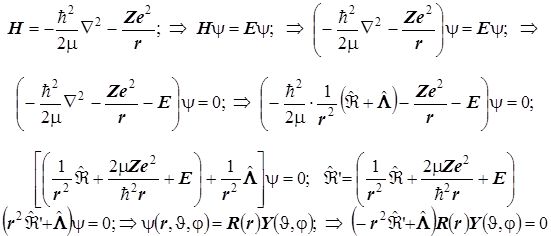
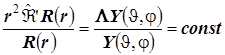
Графики радиальных компонент АО атома H и водородоподобного иона.
Радиальные распределения плотности вероятности и физический смысл боровского радиуса в квантовой механике. Энергетическая диаграмма орбитальных уровней атома водорода и водородоподобного иона и природа высокой кратности вырождения одноэлектронных (орбитальных) уровней атома
VIII. Многоэлектронный атом. Многоэлектронный гамильтониан для атома. Потенциальная энергия отталкивания электронов и ее приближенное представление в виде функции экранирования ядра. Межэлектронное отталкивание как возмущение одноэлектронного кулоновского потенциала в атоме (эффект экранирования ядра) и расщепление уровней по побочному квантовому числу l. Энергетические уровни АО многоэлектронного атома (правило Клечковского-Маделунга): “Уровни АО многоэлектронного атома возрастают с ростом суммы квантовых чисел (n+l), а при равных значениях (n+l) ниже лежит уровень с меньшим n”. Экранирование ядра. Одноэлектронный подход к проблеме строения многоэлектронного атома.
| n+l | N,l | АО | n+l | n,l | АО | n+l | n,l | АО | n+l | n,l | АО | n+l | n,l | АО | n+l | n,l | АО |
| 1 | 1,0 | 1s | 3 | 2,1 | 2p | 5 | 3,2 | 3d | 6 | 4,2 | 4d | 7 | 4,3 | 4f | 8 | 5,3 | 5f |
| 2 | 2,0 | 2s | 3,0 | 3s | 4,1 | 4p | 5,1 | 5p | 5,2 | 5d | 6,2 | 6d | |||||
| 4 | 3,1 | 3p | 5,0 | 5s | 6,0 | 6s | 6,1 | 6p | 7,1 | 7p | |||||||
| 4,0 | 4s | 7,0 | 7s | 8,0 | 8s |
Последовательность уровней АО многоэлектронного атома:
1s<2s<2p<3s<3p<4s<3d<4p<5s<4d<5p<6s<4f<5d<6p<7s<5f<6d<7p<8s
Качественное понятие о спине электрона и принцип Паули.
Принципы заполнения атомных орбиталей в основной электронной конфигурации: 1) водородоподобие (одноэлектронное приближение в атоме), 2) минимум энергии, 3) принцип Паули, 4) максимальный суммарный спин (1-е правило Хунда). Примеры основных электронных конфигураций легких атомов. Возбужденные атомные конфигурации.
Схема приближенного представления энергии электронного отталкивания в виде энергии экранирования ядра.
| Переменные | Слагаемые электростатической (кулоновской) потенциальной энергии | ||||||
| r1, J1, j1 | V1 | V12 | V13 | V14 | ... | ... | V1z |
| r2, J2, j2 | V2 | V23 | V24 | ... | ... | V2z | |
| ... | ... | ... | ... | ... | ... | ||
| ri, Ji, ji | Vi | Vij | ... | ... | Vi | ||
| rj, Jj, jj | Vj | Vji | ... | Vj | |||
| rz-1, Jz-1, jz-1 | Vz-1 | ... | Vz-1,z | ||||
| rz, Jz, jz | Vz | ||||||
Отдельные слагаемые равны Vi= –Ze2/ri; Vij=+Ze2/rij.
Полное выражение для электростатической потенциальной энергии: 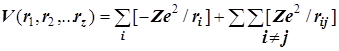
Эффективный потенциал экранирования ядра:
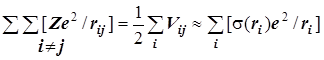
Результирующий эффективный потенциал межэлектронного отталкивания:
![]()
e2s(ri) - заряд экранирования (s(ri) - функция экранирования) ядра
Для одного из электронов потенциальная энергия это одно из слагаемых суммы:
![]()