Реферат: Сульфиды железа (FeS, FeS2) и кальция (CaS)
![]()
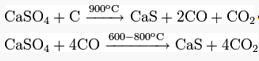
Восстановлением сульфата кальция:
Физические свойства
Белые кристаллы, кубическая гранецентрированная решётка типа NaCl (a=0.6008 нм). При плавлении разлагается. В кристалле каждый ион S2- окружен октаэдром, состоящим из шести ионов Са2+ , в то время как каждый ион Са2+ окружен шестью S2- ионами.
Малорастворим в холодной воде, кристаллогидратов не образует. Как и многие другие сульфиды, сульфид кальция в присутствии воды подвергается гидролизу и имеет запах сероводорода.
Химические свойства
При нагревании разлагается на компоненты:
![]()
В кипящей воде полностью гидролизуется:
![]()
Разбавленные кислоты вытесняют сероводород из соли:
![]()
Концентрированные кислоты-окислители окисляют сероводород:
![]()
Сероводород слабая кислота и может вытесняться из солей даже углекислым газом:
![]()
При избытке сероводорода образуются гидросульфиды:
![]()
Как и все сульфиды, сульфид кальция окисляется кислородом:
![]()
Применение
Применяют для приготовления люминофоров, а также в кожевенной промышленности для удаления волос со шкур, также применяется в медицинской промышленности в качестве гомеопатического средства.
Химическое выветривание
Химическое выветривание — это совокупность различных химических процессов, в результате которых происходит дальнейшее разрушение горных пород и качественного изменения их химического состава с образованием новых минералов и соединений. Важнейшими факторами химического выветривания являются вода, углекислый газ и кислород. Вода — энергичный растворитель горных пород и минералов.
Реакции, протекающей при обжиге сульфида железа в кислороде:
4FeS + 7O2 → 2Fe2 O3 + 4SO2
Реакции, протекающей при обжиге дисульфида железа в кислороде:
4FeS2 + 11O2 → 2Fe2 O3 + 8SO2
При окислении пирита в стандартных условиях образуется серная кислота:
2FeS2 +7O2 +H2 O→2FeSO4 +H2 SO4
При попадании сульфида кальция в топку могут происходить следующие реакции:
2CaS + 3O2 → 2CaO + 2SO2