Реферат: Теплоемкость органических веществ и ее прогнозирование методом Бенсона и при повышенном давлении
1. Рассчитываются теплоемкости при заданных температурах. Результаты расчета для 300, 400, 500, 600 и 800 К приведены в табл. 3.1.
Температурная зависимость теплоемкости имеет нелинейный характер и иллюстрируется рис. 3.1. Там же дан вид аппроксимирующего уравнения. Из рисунка видно, что принятым в таблицах Бенсона температурным диапазонам, действительно, свойственен близкий к линейному вид для температурных зависимостей теплоемкости.
2. Вычисляется теплоемкость при заданных температурах.
T = 325,0 K
![]() = (228,7–174,25)/100×25+174,25 = 187,9 Дж/(моль×К);
= (228,7–174,25)/100×25+174,25 = 187,9 Дж/(моль×К);
![]() = –0,0003×3252 +0,7339×325–17,615 = 189,2 Дж/(моль×К);
= –0,0003×3252 +0,7339×325–17,615 = 189,2 Дж/(моль×К);
Расхождение в оценках: (189,2–187,9)/187,9×100 = 0,7 % отн.
T = 487,5 K
![]() = (277,15-228,7)/100×87,5+228,7 = 271,1 Дж/(моль×К);
= (277,15-228,7)/100×87,5+228,7 = 271,1 Дж/(моль×К);
![]() = –0,0003×487,52 +0,7339×487,5–17,615 = 268,9 Дж/(моль×К);
= –0,0003×487,52 +0,7339×487,5–17,615 = 268,9 Дж/(моль×К);
Расхождение в оценках: -0,8 % отн.
T = 780,0 K
![]() = (374,63–315,16)/200×180+315,16 = 368,7 Дж/(моль×К);
= (374,63–315,16)/200×180+315,16 = 368,7 Дж/(моль×К);
![]() = –0,0003×7802 + 0,7339×780–17,615 = 372,3 Дж/(моль×К).
= –0,0003×7802 + 0,7339×780–17,615 = 372,3 Дж/(моль×К).
Расхождение в оценках: 1 % отн.
Таблица 3.1
|
Тип атома или группы | Кол-во | Теплоемкость в Дж/(моль·К) при температуре, К | |||||||||
| 300 | 400 | 500 | 600 | 800 | |||||||
| Парц. вклад | Парц. вклад | Парц. вклад | Парц. вклад | Парц. вклад | |||||||
| CH3–(C) | 2 | 25,91 | 51,82 | 32,82 | 65,64 | 39,95 | 79,9 | 45,17 | 90,34 | 54,5 | 90,34 |
| CH–(3C) | 1 | 19,00 | 19,00 | 25,12 | 25,12 | 30,01 | 30,01 | 33,7 | 33,7 | 38,97 | 38,97 |
| CH2–(С,Cb) | 1 | 24,45 | 24,45 | 31,85 | 31,85 | 37,59 | 37,59 | 41,9 | 41,9 | 48,1 | 48,1 |
| Cb-(H) | 5 | 13,56 | 67,80 | 18,59 | 92,95 | 22,85 | 114,25 | 26,37 | 131,85 | 31,56 | 157,8 |
| Cb–(C) | 1 | 11,18 | 11,18 | 13,14 | 13,14 | 15,4 | 15,40 | 17,37 | 17,37 | 20,76 | 20,76 |
| | 10 | 174,25 | 228,7 | 277,15 | 315,16 | 374,63 | |||||
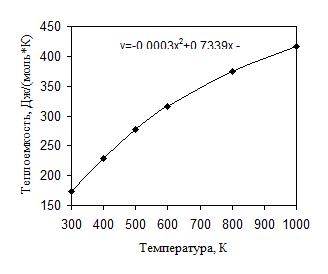
Рис. 3.1. Температурная зависимость идеально-газовой теплоемкости изобутилбензола
Таким образом, прогнозирование теплоемкости при температурах, которые не кратны 100 К, может практически с равным успехом осуществляться как линейной интерполяцией “соседних” значений теплоемкостей при температурах, кратных 100 К, так и на основе аппроксимирующего их уравнения.
3.2. Теплоемкость органических веществ,
находящихся при повышенных давлениях [6]
Экспериментальные сведения о теплоемкости при высоких давлениях являются ограниченными. Поэтому прогнозирование теплоемкости оказывается неизбежным в большинстве практических расчетов. Поскольку речь идет о свойстве веществ в реальном состоянии, методы прогнозирования основаны на принципе соответственных состояний. При массовых расчетах широко используется подход, основанный на разложении Питцера, которое для теплоемкости принимает вид
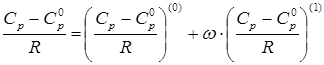 ,(3.7)
,(3.7)
где w - ацентрический фактор,
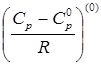 - поправка к теплоемкости на давление, характеризующая поведение простого вещества,
- поправка к теплоемкости на давление, характеризующая поведение простого вещества,
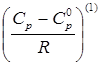 - функция отклонения в поведении рассматриваемого вещества от поведения простого вещества,
- функция отклонения в поведении рассматриваемого вещества от поведения простого вещества,
![]() - идеально-газовая теплоемкость вещества при рассматриваемой температуре,
- идеально-газовая теплоемкость вещества при рассматриваемой температуре,
![]() - искомая теплоемкость,
- искомая теплоемкость,
R - газовая постоянная, равная 8,31441 Дж/(моль×К), или 1,98725 кал/(моль×К).