Реферат: Центральная нервная система взрослого млекопитающего
Центральная нервная система взрослого млекопитающего имеет ограниченные возможности для регенерации. Перерезка большинства проводящих путей не сопровождается ростом аксонов и восстановлением функции. Однако, как описано ранее, в некоторых ситуациях после повреждений в центральной нервной системе неповрежденные аксоны могут разветвляться и с высокой специфичностью формировать новые синапсы. Более того, при повреждении даже больших участков ЦНС аксоны в благоприятных условиях могут удлиняться на несколько сантиметров и в некоторых случаях формировать синапсы с соответствующими мишенями.
Роль глиальных клеток в регенерации ЦНС
Важнейшую роль в ограничении регенерации в центральной нервной системе играют глиальные клетки. Ингибирующая активность глиальных клеток ЦНС была установлена в нескольких типах экспериментов. Во-первых, было показано, что, хотя в ЦНС перерезанные аксоны, как правило, не регенерируют, мотонейроны, локализующиеся в передних рогах спинного мозга, могут восстанавливать поврежденные периферические аксоны (рис. 1). Подобным же образом аксоны чувствительных нервов регенерируют к их мишеням на периферии, хотя они и не способны к восстановлению повреждения в пределах ЦНС. Так, после перерезки заднего корешка чувствительные аксоны регенерируют к спинному мозгу, но прекращают свой рост тогда, когда они достигают астроцитов, локализующихся на границе центральной нервной системы. Кроме того, периферические аксоны в зрительной системе не способны проникать в трансплантант зрительного нерва, который имеет в своем составе глиальные клетки. Эти данные позволяют предположить, что глиальные клетки ЦНС активно ингибируют рост аксонов.
С другой стороны, известно, что, когда нейроны спинальных ганглиев пересаживаются в белое вещество ЦНС с минимальной травматизацией, они способны формировать протяженные аксоны, прорастать в серое вещество и образовывать конечные синаптические разветвления. Таким образом, при отсутствии травмы, индуцирующей глиальную реакцию, регенерация аксонов не зависит от контакта с глиальными клетками ЦНС.
Если проводящие пути в ЦНС повреждены, астроциты, микроглиальные клетки, менингеальные клетки и предшественники олигодендроцитов аккумулируются в зоне повреждения, формируя глиальный рубец. Эти клетки продуцируют разнообразные молекулы, включая свободные радикалы, окись азота, производные арахидоновой кислоты и протеогликаны, ингибирующие аксональный рост. Например, Шваб и его коллеги нашли, что олигодендроциты в зрелой ЦНС имеют на своей поверхности белки, обозначаемые N1-35 и N1-250, вызывающие коллапс конуса роста нейронов и ингибирующие рост нервных клеток in virro . Аппликация моноклональных антител к этим белкам нейтрализовала их тормозную активность. Более того, в присутствии антител аксоны могли прорастать через поврежденный участок спинного мозга и частично восстанавливать двигательную функцию, хотя степень регенерации была явно неполной. Аппликация антител способствовала также спраутингу интактных нервных волокон и формированию дополнительных синапсов, что также может играть роль в восстановлении потерянной функции. Механизм действия антител является, по-видимому, достаточно сложным. В качестве дополнительного механизма, участвующего в спраутинге и нейрональном росте, может выступать местное, индуцированное антителами воспаление.

Рис. 1. Аксоны чувствительных и двигательных нейронов регенерируют на периферии, но не в ЦНС (А) Мотонейроны, сенсорные нейроны ганглиев дорзальных корешков (DRG) и их аксональные отростки в нервной системе млекопитающего. (В) Места повреждений аксона. (С) Степень регенерации. Аксоны нейронов DRG и мотонейроны регенерируют через места повреждения в периферических нервах и дорэальных корешках (затемнение на волокнах в местах повреждения). Тем не менее регенерирующие волокна дорзального корешка прекращают рост, достигнув отростков астроцитов ограничивающих поверхность спинного мозга. Аксоны чувствительных нейронов DRG не регенерируют также через глиальные рубцы (Glial scar), формирующиеся в местах повреждения ЦНС (затемнение с высветленной серединой).
Мосты из шванновских клеток и регенерация
Шванновские клетки создают благоприятное окружение для роста аксонов нейронов ЦНС. Например, при имплантации сегментов периферических нервов между перерезанными участками спинного мозга мыши или крысы, регенерирующие нервные волокна прорастают в поврежденный участок и заполняют зону повреждения. Имплантант состоит из шванновских клеток и соединительной ткани; периферические аксоны при этом дегенерированы. Подобным же образом способствует росту нейронов культура шванновских клеток, имплантированная в спинной мозг. Этот эффект может быть значительно усилен модификацией шванновских клеток методами генной инженерии, приводящими к продукции повышенного уровня нейротрофических факторов. Введение суспензии инкапсулирующих глиальных клеток в культю перерезанного спинного мозга или в зону электролитического повреждения кортикоспинального тракта также усиливает регенерацию аксонов. Наличие инкапсулирующих глиальных клеток является характерной особенностью обонятельного аппарата, где даже во взрослом организме происходит рождение новых нейронов и прорастание их аксонов в ЦНС.
Поразительный эффект восстановления утерянной функции наблюдается при использовании мостиков (рис. 2.) . Один конец седалищного нерва имплантирован в спинной мозг, а другой — в вышележащий отдел нервной системы (спинной мозг, продолговатый мозг или таламус). Мостики можно даже протягивать от коры больших полушарий головного мозга к другому участку ЦНС или к скелетной мышце. После нескольких недель или месяцев имплантант приобретает сходство с нормальным нервным проводником, наполненным миелинизированными или немиелинизированными аксонами. Эти нейроны являются электрически возбудимыми и способными генерировать распространяющиеся нервные импульсы. Более того, они способны ингибироваться стимулами, приложенными выше или ниже зоны имплантации. При перерезке тканей в области мостика и загрузке обрезанных концов пероксидазой хрена (или другими маркерами) можно установить происхождение прорастающих нервных волокон (рис. 2.В). Такие эксперименты показали, что аксоны, заполнившие мостик, происходят из нейронов, клеточные тела которых лежат внутри центральной нервной системы. Обычно в мостик прорастают только те нейроны, тела которых располагаются на расстоянии не более нескольких миллиметров от мостика. Подобным же образом аксоны, вышедшие из мостика, способны прорастать в центральную нервную систему только на короткую дистанцию.

Рис. 2. Мостики между продолговатым и спинным мозгом дают возможность нейронам ЦНС прорастать на длинные расстояния. Имплантированный мостик состоит из куска седалищного нерва взрослой крысы с деге нерированными аксонами, с сохранившимися шванновскими клетками. Этот мостик функционирует как канал, по которому могут прорастать центральные аксоны. (А) Место приложения имплантанта. (В) Нейроны метили перерезкой имплантанта и наложением HRP к перерезанным концам. Позиции 1 472 клеточных тел нейронов были помечены ретроградным транспортом HRP y семи крыс с имплантантом. Большинство клеток, посылающих аксоны в имплантант, были расположены вблизи него.
Не все нейроны ЦНС даже в благоприятном окружении способны удлинять аксоны. Например, при перерезке аксонов клеток Пуркинье мозжечка у взрослых животных выживают все утратившие отростки нейроны, но это не сопровождается регенерацией аксонов, даже если в поврежденный участок имплантируются кусочки эмбрионального мозжечка. Между тем такие имплантанты эффективно стимулируют прорастание аксонов других мозжечковых нейронов. Таким образом, регенерация зависит как от условий, разрешающих или активирующих рост нервных клеток, так и от внутренних характеристик, присущих данному нейрону. Отсутствие способности к регенерации поврежденных отростков у клеток Пуркинье коррелирует с тем, что в их цитоплазме при аксотомии не происходит повышения синтеза белков, обеспечивающих рост аксонов.
Формирование синапсов при регенерации аксонов в ЦНС млекопитающих
Могут ли аксоны, регенерирующие в ЦНС млекопитающих, правильно находить свои мишени и создавать функционирующие синапсы? Эксперименты на регенерирующих аксонах ганглиозных клеток сетчатки дали положительный ответ на этот вопрос. Если после перерезки зрительного нерва в поврежденный участок между глазом и верхним четверохолмием вставляли мостик, состоящий из периферического нерва, аксоны ганглиозных клеток сетчатки прорастали через мост, достигали своей цели, ветвились и образовывали синапсы (рис. 3.). Под электронным микроскопом регенерированные синапсы, образованные в должных участках клеток-мишеней имели нормальную структуру, и являлись функционирующими, о чем свидетельствовало то, что освещение глаза вызывало генерацию электрических сигналов в постсинаптических клетках.

Рис. 3. Соединение сетчатки и верхнего бугра с помощью имплантанта периферического нерва у взрослой крысы. (А) Зрительные нервы были пересечены, один из них был замещен отрезком малоберцового нерва длиной 3--4 см (серый цвет). Регенерация тестировалась с помощью меток, антероградно перемещаемых после инъекций в глаз или регистрацией ответов нейронов верхнего бугра на освещение сетчатки. (В) Электронно-микроскопическая аут радиограмма регенерированной терминали аксона ганглиоэной клетки сетчатки в верхнем бугорке. [ Н]-меченые аминокислоты были инъецированы в глаз за2 дня до получения срезов мозга; серебряные зерна, показывающие меченые белки, транспортированные из глаза, служили для распознавания терминален аксона ганглиозных клеток. Регенерированные терминали были похожи на таковые у контрольных животных; они были заполнены круглыми синаптическими везикулами и формировали асимметричные синапсы.
Регенерация в незрелой ЦНС млекопитающих
По сравнению с нервной системой взрослых, незрелая ЦНС млекопитающих обеспечивает более благоприятные условия для регенерации. Например, если спинной мозг новорожденного опоссума передавлен или перерезан, аксоны прорастают через участок повреждения. Проводимость через поврежденный участок восстанавливается через несколько дней, даже если спинной мозг извлечен и помещен в культуральную среду. Сходные результаты получены на эмбриональном спинном мозге крысы и мыши в условиях культуры. У новорожденного опоссума даже после полного пересечения спинного мозга после заживления наблюдается полная и точная регенерация и отличное восстановление функций. Например, аксоны чувствительных нейронов восстанавливают прямые синаптические связи с двигательными нейронамии животное может координирование ходить, плавать и прыгать.
Спинной мозг 9-дневного опоссума регенерирует хорошо, а 12-дневного — уже нет. Поразительным свойством спинного мозга 9--дневного опоссума является отсутствие миелина и малое количество глиальных клеток. Действительно, конец критического периода, в течение которого может осуществляться успешная регенерация, совпадает с появлением олигодендроцитов, миелиновых оболочек и ингибирующих нейрональный рост протеинов N1-35 и N1-250. Сходно с этим, у эмбрионов цыплят нейроны ствола мозга будут успешно регенерировать свои спинальные аксоны, если спинной мозг был рассечен до начала миелинизации. Позже регенерация становится невозможной, за исключением тех случаев, когда миелинизания волокон по какой-то причине запаздывает или если она нарушена. Эти экспериментальные модели дают возможность изучения молекулярных механизмов, облегчающих и ингибирующих регенерацию в центральной нервной системе

Рис. 4. Процедура трансплантации ткани эмбриона в мозг взрослой крысы. Ткань, богатая клетками, содержащими дофамин, бралась из черной субстанции (А) и инъецировалась в боковой желудочек (В) или имплантировалась в пространство коры, покрывающей базальные ганглии (С). Как альтернативный подход, суспензия диссоциированных клеток черной субстанции могла быть инъецирована непосредственно в базальные ганглии (D). Эти эмбриональные клетки выживали, росли и секретировали трансмиттер.
Нейрональные трансплантаты
Наиболее распространенными заболеваниями ЦНС человека являются болезни, обусловленные спонтанной дегенерацией нейронов, такие как болезни Паркинсона, Альцгеймера и Хантингтона Большинство нервных клеток у взрослых являются постмитотическими; в настоящее время неизвестны физиологические механизмы восстановления утерянных нейронов. Одним из подходов для замещения погибших нервных клеток, предпринятых Бьерклундом и коллегами, являлась трансплантация нервных клеток эмбриона в мозг взрослого организма. В отличие от нейронов взрослого организма, погибающих при трансплантации, нервные клетки эмбрионов или новорожденных животных после перемещения в серое вещество ЦНС взрослого выживали и развивались (рис. 4.). Имплантированные клетки дифференцировались, проращивали аксоны и освобождали нейротрансмиттеры из нервных терминалей.
Ярким примером такого рода являются эксперименты, в которых после разрушения дофамин-содержащих нейронов черной субстанции эмбриональные нейроны были трансплантированы в базальные ганглки крысы. Гибель нейронов черной субстанции воспроизводит дефицит, напоминающий болезнь Паркинсона у людей. У нормальных животных дофаминергические нейроны черной субстанции, располагающиеся в среднем мозге, иннервируют клетки базальных ганглиев (часть мозга, вовлеченная в программирование движений, аппендикс). При одностороннем повреждении этого дофаминового тракта результатом было нарушение движения; в ответ на стрессовый сигнал животное поворачивалось в сторону повреждения. Эта асимметрия движений исчезала после трансплантации в базальные ганглии на стороне повреждения дофаминсодержаших эмбриональных нейронов черной субстанции. Улътраструктурные исследования показали, что трансплантированные нейроны удлиняют аксоны, проникая в окружающие участки мозга и формируя синапсы с нейронами реципиента.
Степень функциональной компенсации в результате операции трансплантации нейронов зависит от успешности восстановления синаптических контактов. Удивительно, что полноценная интеграция нейронов в сложную нейрональную сеть мозга происходит нормально у взрослого. Так же хорошо у взрослых происходит восстановление после имплантации эмбриональной ткани в поврежденную кору, гиппокамп и полосатое тело. Трансплантированная в мозг новорожденной крысы эмбриональная сетчатка способна к формированию специфических функциональных синапсов, восстанавливая таким образом соответствующие зрительные рефлексы. Трансплантация эмбриональной энторинальной коры взрослым крысам с повреждениями энторинальной коры головного мозга может реиннервировать деафферентированные зоны гиппокампа, формировать синаптические контакты и частично восстанавливать дефицит пространственной памяти.
Ярким примером регенерации нервной системы является анатомическая и функциональная интеграция трансплантированных эмбриональных клеток Пуркинье мозжечка у взрослой мутантной мыши с дегенерацией собственных клеток Пуркинье (рис. 5.). Сотело и его коллеги трансплантировали диссоциированные клетки Пуркинье либо целые кусочки эмбриональной ткани в мозжечок взрослой мутантной мыши. Донорские клетки Пуркинье мигрировали из трансплантанта в зоны, где исходно располагались дегенерировавшие впоследствии клетки Пуркинье. Они продвигались вдоль глиальных клеток Бергмана, в которых была индуцирована экспрессия белков, управляющих движением донорских клеток Пуркинье. Через 2 недели многие трансплантированные клетки формировали дендритные деревья, похожие на разветвления обычных клеток Пуркинье, лиановидные волокна образовывали синапсы сначала на клеточном теле, затем на проксимальных дендритах, а параллельные волокна иннервировали дистальные дендриты. Характерные синаптические потенциалы были зарегистрированы после стимуляции входов лиановидных и мшистых волокон. Тем не менее имплантированные клетки редко устанавливали синаптические связи с их обычными мишенями в глубоких ядрах мозжечка. Вместо этого они стремились установить связи с донорскими нейронами, перенесенными и выжившими в составе трансплантанта. Несмотря на это, проведенные эксперименты демонстрируют, что трансплантированные нервные клетки могут в значительной мере интегрироваться в нейрональную сеть взрослого организма.
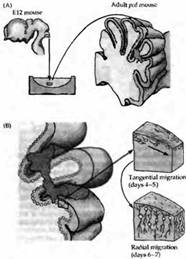
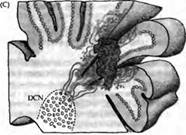
Рис. 5. Реконструкция нейрональной сети мозжечка трансплантацией мозговой ткани эмбриона во взрослую мутантную мышь (pcd), y которой клетки Пуркинье дегенерируют вскоре после рождения. (А) Цельные участки мозжечковой ткани от 12-дневного эмбриона (Е12) были инъецированы в мозжечок 2-4-месячных pcd мышей. (В) К 4-5 дню после трансплантации клетки Пуркинье мигрировали от трансплантанта по линии, касательной к мозговой поверхности. Через 6-7 дней после трансплантации клетки Пуркинье начинали мигрировать в радиальном направлении внутрь ткани мозжечка по глиальным клеткам Бергмана, пронизывая молекулярный слой. (С) Донорские клетки Пуркинье, находящиеся на расстоянии не более 600 мкм от глубинных ядер мозжечка (ГЯМ) реципиента, тянут аксоны к ГЯМ и формируют синаптический контакт на специфических мишенях. Те же донорские клетки Пуркинье, которые располагаются на большем расстоянии, контактируют преимущественно с донорскими же клетками ГЯМ, попавшими сюда вместе с трансплантантом.
Ясно, что многое нейроны ЦНС млекопитающих сохраняют даже во взрослом состоянии удивительную способность к регенерации аксонов и дендритов и восстановлению соответствующих синаптических связей. Главной причиной несостоятельности регенерации после большинства повреждений ЦНС является ингибирование врожденных регенеративных возможностей факторами, производимыми глиальными клетками и трофическими молекулами, влияющими на рост нейронов. Идентификация механизмов подавления эндогенных тормозных факторов является областью активных научных исследований, так же как и изучение нейрональных стволовых клеток, представляющих собой потенциальный источник новых глиальных клеток и нейронов, чьи свойства могут быть адаптированы методами генной инженерии. Успехи в этой области в сочетании с развитием трансплантационной техники дают надежду на восстановление функционального дефицита, возникающего в результате повреждений и нейродегенеративных заболеваний ЦНС.
Выводы
∙ При перерезке аксона в нервной системе позвоночных происходит дегенерация дистального отдела нерва. Аксотомированная клетка либо подвергается хроматолизу, либо погибает.
∙ Многие пресинаптическиетерминали, иннервирующие аксотомированные нейроны, подвергаются ретракции; оставшиеся окончания освобождают сниженное количество квантов нейротрансмиттера.
∙ В денервированных скелетных мышечных волокнах в экстрасинаптических участках происходит синтез и экспрессия новых АХ рецепторов, что делает мышцу гиперчувствительной к АХ. Денервированные нейроны также становятся гиперчувствительными к трансмиттерам, освобождающимся из поврежденных синаптических аксонов.
∙ Мышечная активность является важным фактором, определяющим количество АХ рецепторов и их распределение. Мышечная активность влияет также на скорость деградации и восстановления АХ рецепторов.
--> ЧИТАТЬ ПОЛНОСТЬЮ <--