Реферат: Вплив лерканідипіну і бісопрололу на функції ендотелію у хворих на гіпертонічну хворобу, поєднану з ішемічною хворобою серця
Для статистичного аналізу використовували пакет програм Statistica for Windows версії 6.0 (Stat Soft inc., США) та EpiInfo 2000, версія 3.3.2. Вірогідність різниці визначали t-критерієм Стьюдента та F-критерієм Фішера для параметричних даних. При непараметричному розподілі використовували для множинного порівняння – Н-критерій Краскела-Уоліса, для парного – ранговий U-критерій Манна-Уітні (у випадку незалежних вибірок) та Т-критерій Вілкоксона (у випадку залежних груп). Для оцінки міри залежності між перемінними використовували кореляційний аналіз за Пірсоном та коефіціент рангової кореляції Спірмена. Для оцінки ступеня факторного впливу використовували метод Снедекора. Оцінка ефективності лікування проводилась із урахуванням виходів лікування, абсолютного (АЕ,%) та відносного (ВЕ) терапевтичних ефектів, терапевтичної користі (різниця АЕ), а також відношення шансів (ВШ) препаратів, із розрахунком довірчих інтервалів та критерію вірогідності щодо ВЕ та ВШ. При р<0,05 розбіжності вважали статистично вірогідними.
Результати дослідження та їх обговорення. За аналізу кардіогемодинаміки було встановлено, що у хворих на ГХ зі СС більш суттєво зменшуються показники систолічної функції ЛШ: фракція викиду (ФВ), ударний об’єм, ударний індекс, хвилинний об’єм крові, серцевий індекс порівняно з хворими на ГХ без СС (р<0,05). Маса міокарда (ММ), індекс маси міокарда (ІММ) та відносна товщина стінок лівого шлуночка (ВТСЛШ) у хворих із поєднаним перебігом ГХ та СС перевищували відповідні показники у хворих на ГХ без СС (р1-3<0,05). Враховуючи таку тенденцію, у пацієнтів із ГХ та СС частіше, ніж у хворих на ГХ без СС, визначались патологічні типи геометрії ЛШ, із переважанням концентричної гіпертрофії міокарда. За результатами кореляційного аналізу встановлено вірогідний (p=0,02) зворотній кореляційний зв’язок середньої сили (r=-0,27) між ММ та ФВ ЛШ. При визначенні міри факторного впливу ГХ та СС на параметри ремоделювання ЛШ встановлено, що зміна ММ та ІММ залежить більшою мірою від ГХ (37,9%, p<0,001), ніж від СС (28,4%, p<0,001), а зміни ВТСЛШ обумовлені асоційованим впливом ГХ та СС (55,7%, p<0,001).
За результатами ультразвукового дослідження ЗСА було встановлено, що величина КІМ ЗСА у хворих на ГХІІ без СС не відрізнялась від контролю (p>0,05), однак мала місце асиметрія КІМ правої та лівої ЗСА (22,0%, р<0,05). У хворих із поєднаним перебігом ГХ та СС відмічається збільшення величини та ступеня асиметрії КІМ ЗСА відносно групи хворих на ГХ без СС (р1-3<0,05). У ВСА величина КІМ у хворих на ГХ без СС вірогідно збільшувалась відносно контролю лише справа (p<0,05), у хворих із поєднаним перебігом ГХ та СС дані зміни реєструвались з обох сторін (p<0,05), при чому товщина КІМ у ВСА та ступінь асиметрії залежали від стадії ГХ та ФК стенокардії (рис.1).

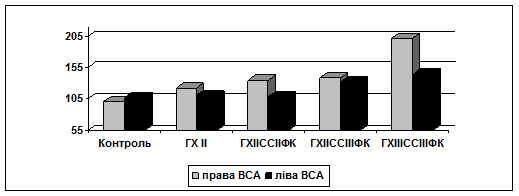
Рис.1. Величина комплексу інтима-медіа (%) внутрішніх сонних артерій у хворих на неускладнену гіпертонічну хворобу та гіпертонічну хворобу зі стабільною стенокардією.
При моделюванні міри факторного впливу встановлено, що ступінь впливу стенокардії на величину КІМ переважав ступінь впливу ГХ у ЗСА (41,3 проти 24,5% справа, 38,3% проти 23,0% зліва), ВСА (38,0 проти 21,6% справа та 42,1 проти 27,0% зліва) та Зов. СА (46,1 проти 21,6% справа та 40,7 проти 29,7% зліва) СА.
Діаметри ЗСА у хворих на ГХ без СС не відрізнялись від контролю (p>0,05), проте вірогідно перевищували норму при поєднаному перебігу ГХ та СС (р<0,05). Водночас, як у пацієнтів з ГХ без СС, так і за поєднаного перебігу ГХ та СС (p<0,05) діаметр ВСА вірогідно перевищував контроль, причому збільшення діаметру ВСА виявлялось навіть за незміненого КІМ. У всіх випадках був встановлений прямий кореляційний зв’язок між ММ ЛШ, діаметром та КІМ СА (табл.1).
Таблиця 1. Кореляційний зв’язок між масою міокарда лівого шлуночка, діаметром та комплексом інтима-медіа зовнішніх і внутрішніх сонних артерій
| Права ЗСА | Ліва ЗСА | Права ВСА | Ліва ВСА | |||||
| КІМ | діаметр | КІМ | діаметр | КІМ | діаметр | КІМ | діаметр | |
| ММЛШ | r=0,36* | r=0,50* | r=0,24 | r=0,45* | r=0,36* | r=0,43* | r=0,40* | r=0,30* |
* – вірогідний кореляційний зв’язок.
При дослідженні функціонального стану ендотелію, зокрема, судинно-тромбоцитарного гемостазу було встановлено, що у хворих на ГХ без СС та ГХ зі СС спостерігається зростання ступеня спонтанної агрегації тромбоцитів відносно такої в практично здорових осіб (p<0,05), із більш значними змінами за наявності ГХ зі СС (p1-3<0,05), у той час, як АДФ-індукована агрегація вірогідно підвищувалась лише у хворих на ГХ зі СС (p<0,05). Час агрегації тромбоцитів та швидкість агрегації вірогідно не відрізнялись у хворих на ГХІ, ГХІІ, ГХІІССІІФК та контролем, проте змінювались (час скорочувався, швидкість зростала) у хворих на ГХІІССІІІФК та ГХІІІССІІІФК (p<0,05). Окрім того, у хворих із ГЛШ зареєстрований більш високий рівень АДФ-індукованої (р=0,051) агрегації тромбоцитів та вірогідне зменшення часу агрегації (p<0,05) відносно пацієнтів без ГЛШ, причому за наявності концентричної ГЛШ ці зміни були більш значними (p<0,05), ніж у хворих із іншими типами ремоделювання міокарда. Також встановлено пряму кореляційну залежність між величиною КІМ ЗСА (r=0,38, p<0,05) та ВСА (r=0,44, p<0,05) та ступенем АДФ-індукованої агрегації тромбоцитів.
Оцінку стану антикоагулянтної активності за рівнем протеїну С (PtC) проводили шляхом кластерного аналізу, у результаті чого було отримано 3 кластери з достовірною різницею між ними (p<0,05), що дозволило розподілити хворих на три групи: із незначним зниженням рівня протеїну С (група 1–72 осіб), із суттєвим зниженням протеїну С (група 2–20 осіб) та з вірогідним підвищенням рівня протеїну С (група 3– 23 осіб) у порівнянні з контролем. При аналізі нозологічної структури встановлено, що в більшості хворих на ГХІ, ГХІІ та ГХІІССІІФК є незначне зниження (р<0,05) рівня протеїну С, у хворих на ГХІІССІІІФК встановлено його суттєве зниження (р<0,01), а у хворих на ГХІІІСІІІФК – його підвищення (р<0,05) щодо контролю.
За аналізу результатів дослідження фібринолітичної активності крові було відмічено вірогідне зниження ПАП (р<0,05) у хворих на ГХ без СС та ГХ зі СС відносно контролю. Спостерігалось також вірогідне зниження СФА (р<0,05) у пацієнтів зі структурними змінами СА. У хворих із ГЛШ встановлено вірогідне підвищення інтенсивності лізису азоказеїна (p<0,01), а у хворих зі структурними змінами СА – зростання інтенсивності лізису азоальбуміна (р<0,05).
Розвиток коронарних колатералей та здатність ендотелію до проліферації залежить від співвідношення між стимуляторами та інгібіторами ангіогенезу, із них найбільше значення має судинний ендотеліальний фактор росту – VEGF. У хворих на ГХ зі СС рівень VEGF складав 35,0 (7,6-68,7) пг/мл, що є вірогідно нижчим (р<0,01), ніж у групі практично здорових осіб – 89,3 (65-126) пг/мл. У хворих на ГХІІССІІФК рівень VEGF-165 становив 59,4 (52,8-79,5) пг/мл (р<0,05), за наявності ГХІІССІІІФК – 8,3 (1,0-42,9) пг/мл (р<0,01), ГХІІІССІІІФК – 13,8(6,9-27,1) пг/мл (р<0,05).
Встановлено підвищення рівня загального ХС та β-ЛП у хворих на ГХ зі СС та ГХ без СС відносно контролю (p<0,01) та залежність вмісту ХС від структурних змін СА (p<0,01). Також у хворих на ГХ з супутньою СС та ГХ без СС спостерігалось зменшення індексу деформабельності еритроцитів (ІДЕ, р<0,001) та зростання коефіцієнту в’язкості еритроцитарної суспензії (КВЕС, p<0,05) відносно практично здорових осіб.
Зміни показників, що характеризують функцію ендотелію та параметри ремоделювання ЛШ та СА аналізувались в динаміці лікування у хворих на ГХІІССІІІФК.
При застосуванні бісопрололу відбувалось зниження спонтанної (на 38,3%, р=0,01) та АДФ-індукованої агрегації тромбоцитів (у 2,9 рази, р=0,07), подовження часу агрегації на (у 2,1 рази, р=0,03) та зниження швидкості агрегації тромбоцитів (на 47,1%, р=0,06). На фоні застосування лерканідипіну рівень спонтанної тромбоцитарної агрегації знижувався на 6,6% (р=0,1), АДФ-індукованої – в 2,1 рази (р<0,01), час агрегації тромбоцитів подовжувався на 18,0% (р=0,1), швидкість агрегації уповільнювалась у 2,3 рази (р<0,01). За кожним параметром обчислювали абсолютну кількість хворих, в яких було досягнуто бажаного ефекту та кількість хворих, де бажаний ефект не досягався. Рівень спонтанної агрегації на фоні 12-тижневого прийому бісопрололу знижувався в 94,1% хворих, на фоні лерканідипіну – у 88,2%, терапевтична користь бісопололу становила 5,9%, ВЕ - 1,07 (0,86-1,32), ВШ – 2,13 (0,13-6,71). Вплив на АДФ-індуковану агрегацію переважав у лерканідипіну (94,1%) у порівнянні з бісопрололом (75,0%), із терапевтичною користю 19,1%, ВЕ - 0,80 (0,59-1,08) та ВШ - 0,19 (0,01-2,25). Швидкість агрегації після застосування лерканідипіну знижувалась у 94,1% пацієнтів та у 64,7% хворих, що отримували бісопролол, тобто терапевтична користь лерканідипіну склала 29,4%, ВЕ - 0,69(0,49-1,0), ВШ - 0,11(0,03-1,24) (рис.2).
У хворих на ГХІІССІІІФК спостерігалось збільшення вмісту фактора ангіогенезу на фоні 12-тижневого лікування як бісопрололом (р<0,05), так і лерканідипіном (р<0,05). Для оцінки вірогідності ефекту позитивним виходом лікування вважали всі випадки збільшення вмісту в крові VEGF, негативним – його зниження або збереження вихідного рівня. Було встановлено більш виражений АЕ лерканідипіну (77,8%) з терапевтичною користю відносно бісопрололу 17,8%.
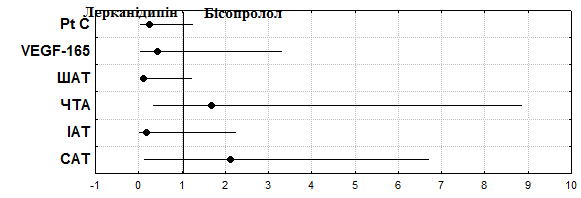
Рис.2. Відношення шансів лерканідипіну та бісопрололу щодо впливу на функції ендотелію у хворих на гіпертонічну хворобу зі стабільною стенокардією.
За оцінки змін антикоагулянтної функції ендотелію в динаміці лікування бісопрололом у хворих на ГХІІССІІІФК спостерігалось збільшення рівня протеїну С на 44,4%, (р=0,03) та 24,7% (р=0,07) при призначенні лерканідипіну, хоча АЕ щодо рівня протеїну С був вищим у лерканідипіну (85,7%) відносно бісопрололу (61,3%), з терапевтичною користю 24,4%, ВЕ 0,72 (0,51-0,99), ВШ 0,26 (0,05-1,26). АЕ бісопрололу щодо ПАП складав 72,3%, з терапевтичною користю 21,1%, ВЕ 1,40(0,93-2,09), ВШ - 2,43(0,81-7,37).
Таким чином, вірогідність впливу на показники судинно-тромбоцитарного гемостазу, антикоагулянтну активність ендотелію та рівень фактора ангіогенезу за виходами лікування в лерканідипіну є більшою (рис.2), хоча не можна заперечувати також вірогідність впливу бісопрололу на ці показники – про що свідчить величина довірчих інтервалів [95%ДІ], тобто обидва препарати мають певний рівень ендотеліопротекторного впливу.
На фоні бісопрололу та лерканідипіну спостерігалась тенденція до зниження рівня ХС (2,7 та 2,4%, p>0,05) та β-ЛП (11,9 та 10,9%, p>0,05), проте вірогідність даного ефекту (АЕ,%) щодо ХС склала 69% для бісопрололу та 66,7% для лерканідипіну, ВЕ 1,04 (0,74-1,45), ВШ - 1,12 (0,35-3,54), для β-ЛП АЕ бісопрололу - 70,7%, лерканідипіну – 59,3%, ВЕ - 1,19 (0,82-1,73), ВШ – 1,66 (0,53-5,22). Вплив препаратів на морфофункціональні властивості еритроцитів виражався у вірогідному збільшенні ІДЕ на фоні як бісопрололу (31,7%, р<0,01), так і лерканідипіну (27,5%, р<0,01) та зниженні КВЕС – 12,1 та 21,4% відповідно (р<0,05). АЕ лерканідипіну щодо КВЕС на 25% переважав АЕ бісопрололу, ВЕ – 0,73 (0,50-1,05), ВШ – 0,18 (0,01-2,05).
За оцінки впливу препаратів на кардіогемодинаміку було виявлено незначне збільшення ФВ ЛШ на фоні бісопрололу (3,5%, р=0,07) без суттєвих змін КДО та КСО (р>0,05). У групі, що отримувала лерканідипін, встановлено вірогідне зменшення КДО ЛШ (на 5,9%, р<0,05) та незначне зменшення КСО (5,94%, р=0,1).
За застосування бісопрололу впродовж 12 тижнів у хворих на ГХІІССІІІФК відмічено зменшення ММ на 7,8%, (р=0,1), ІММ на 6,9% (р=0,1) та ВТСЛШ – на 4,4% (р=0,1), така ж тенденція спостерігалась на фоні лікування лерканідипіном щодо ММ ЛШ, ІММ ЛШ (р=0,051) та ВТСЛШ (р=0,1). За оцінки терапевтичної ефективності бісопрололу АЕ відносно ММ та ІММ склав 78,7%, який переважав відповідний ефект лерканідипіну на 12,0%, ВЕ визначений як 1,18 (0,84-1,65), ВШ – 1,85 (0,51-6,72). АЕ бісопрололу щодо зменшення ВТСЛШ дорівнював 68,0%, що на 6,1% більше ніж у лерканідипіну, ВЕ – 1,10 (0,75-1,62), ВШ – 1,31 (0,39-4,37).
Антигіпертензивна терапія бісопрололом впродовж 12 тижнів у хворих на ГХІІССІІІФК сприяла зменшенню величини КІМ у ЗСА (справа - 7,8%, p>0,05, зліва - 22,4%, р=0,06) та ВСА (відповідно 14,9%, р=0,04 та 18,3%, p>0,05), у Зов. СА вірогідний вплив виявлено лише зліва – на 11,32% (р=0,05). За призначення лерканідипіну такі ж тенденції відносно величини КІМ встановлено в обох ЗСА (7,0%, р=0,07 – права, 32,4%, р=0,062 - ліва) та ВСА (у правій – 25,9%, р=0,1, у лівій – 15,7%, p>0,05), а також у лівій Зов. СА (11,53%, р=0,07). Для оцінки вірогідності ефектів проаналізовано абсолютну кількість випадків за правою та лівою СА, де впродовж лікування відмічалось зменшення КІМ. АЕ лерканідипіну на КІМ ЗСА склав 36,7%, із терапевтичною користю відносно бісопрололу 10,7%, ВЕ – 0,71 (0,37-1,38), ВШ – 0,61 (0, 20-1,79) (рис.3).
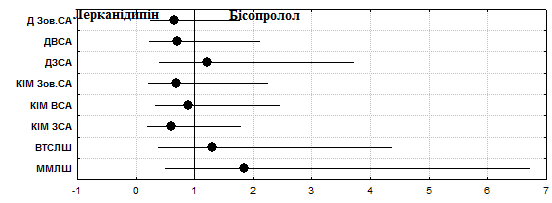
Рис.3. Відношення шансів впливу лерканідипіну та бісопрололу на показники серцевого та судинного ремоделювання у хворих на гіпертонічну хворобу зі стабільною стенокардією.
У ВСА АЕ лерканідипіну склав 56,7%, що перевищило АЕ бісопрололу на 2,7%, ВЕ – 0,95 (0,64-1,43), ВШ – 0,90 (0,33-2,46). У Зов. СА АЕ склав 20,0% у бісопрололу та 26,7% у лерканідипіну. Також підраховувалась кількість випадків, де відмічалося зменшення діаметру СА до кількості випадків, коли діаметр не змінювався. Підрахунок проводився за правою та лівою артеріями диференційовано для ЗСА, ВСА та Зов. СА. У ЗСА переважав АЕ бісопрололу (74,0%), із терапевтичною користю відносно лерканідипіну 4,0%, ВЕ – 1,06 (0,79-1,41), ВШ – 1,22 (0,40-3,73). У ВСА переважав АЕ лерканідипіну (73,3%), із терапевтичною користю 7,3%, ВЕ - 0,90 (0,67-1,21), ВШ – 0,71 (0,23-2,13). У Зов. СА вірогідність впливу препаратів була найменшою (АЕ лерканідипіну – 56,7%, бісопрололу – 46,0%), ВЕ – 0,81 (0,53-1,25), ВШ – 0,65 (0,24-1,78).
Тобто слід відміти переважання ефекту бісопрололу відносно зменшення ММ та ВТСЛШ, проте лерканідипіну властивий більш вірогідний вплив на величину КІМ та діаметри СА (ДЗСА, ДВСА, ДЗов. СА). З іншого боку обидва препарати мають позитивний вплив на ММ та ВТСЛШ, діаметри та величину КІМ СА (рис.3).