Реферат: Золотая и медная минерализация: геохимические и физические процессы
Золотая и медная минерализация: геохимические и физические процессы
Введение
В разделе рассмотрены геохимические механизмы золотомедного рудообразования (минерализация) из гидротермальных растворов и их соотношение с процессами, происходящими в гидротермальных системах. Описаны соотношения главных типов эпитермальных и порфировых золотых и меднорудных месторождений с разными типами гидротермальных систем, геологические факторы, которые контролируют образование и функционирование гидротермальных систем и, почему в каких-то случаях рудообразование не происходит.
1. Геохимия эпитермальных отложений золота
Не все гидротермальные системы содержат промышленные золотые месторождения и не все части рудопроявления имеют одинаковые рудные минералы. Даже большое месторождение золота будет занимать только небольшую часть первичной гидротермальной системы. Цель раздела - определение главных химических и физических механизмов, контролирующих отложение золота, и применяя их, установить специфические факторы, ответственные за образование некоторых месторождений.
Для выполнения поставленных задач необходимо знать, каким образом золото переносится гидротермами при эпитермальных температурах. Обычные гидротермы в гидротермальных системах представляют собой разбавленный минеральный раствор (почти нейтральный, слабо кислый и, в основном, метеорного происхождения). Они содержат растворённые газы, преимущественно СО2> и в меньшем количестве Н2 8. В гидротермах этого типа в интервале эпитермальных температур золото переносится, главным образом, в виде бисульфидного комплекса. Оно может также мигрировать в виде хлоридных комплексов, но в типичных эпитермальных гидротермах этот процесс имеет малое значение. Этот способ более важен при температурах образования порфировых рудообразующих систем или в системах с высоко минерализованными гидротермами. Теллуридные комплексы важны при образовании некоторых месторождений, но химические свойства их аналогичны сульфидным комплексам. Золото, фактически, имеет нулевую растворимость в паре при эпитермальных температурах: таким образом, если пар или газ отделяются, то золото остаётся в жидкой фазе.
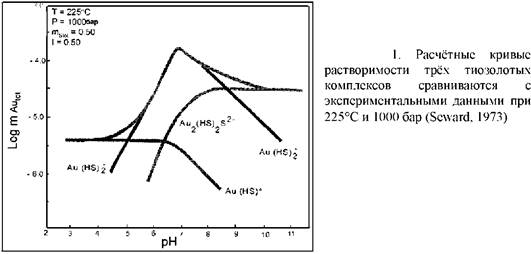
Бисульфидные комплексы золота плохо растворимы и, таким образом, концентрации золота в гидротермальных растворах низкие. Но гидротермальные системы имеют большие размеры и функционируют продолжительное время. Было подсчитано, что до 5 кг/год золота в настоящее время отлагается в гидротермальной системе Бродландс - Охааки в Новой Зеландии. Следовательно, месторождение с запасами 100 тонн могло бы образоваться в течение 20 000 лет. Некоторые системы могут действовать в десятки раз дольше. Sander, Einaudi (1990) пришли к выводу, что запасы золота в Раунд Монтейн в 500 тонн могли отложиться в течение 100 000 лет. Экспериментальные оценки (Seward, 1973) различных видов водных золотых комплексов показывают, что Au (HS) 2 - , по-видимому, преобладает в гидротермах при почти нейтральных рН и малой минерализации. Это позволяет предполагать его участие при образовании эпитермальных месторождений лоу сульфидейшн (рис.1). Расчёт масс-балансов (Brown, 1986), после открытия золото содержащих осадков в геотермальных трубопроводах, согласовывались с экспериментальными данными. Места осаждения осадков при внезапном падении давления свидетельствуют, что золото осаждается в результате кипения. Компьютерное моделирование (Dummond, Ohmoto, 1985) также показало, что золото может отлагаться в результате кипения или смешения гидротерм с водами разного химического состава.
Имеется ряд бисульдных комплексов Аи, которые стабильны в различных химических режимах. Уравнение, описывающее отложение золота из раствора в виде бисульфидного комплекса, представлено так:
2Au (HS) - + H2 + 2H+ и 2Аи + 4H2 S. Смещение уравнения вправо будет способствовать отложению золота. Ниже рассматриваются факторы, изменяющие этот процесс.
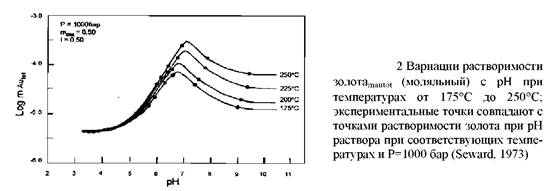
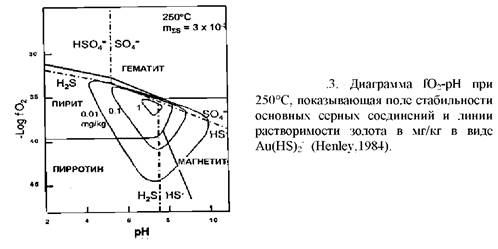
Первым фактором является рН раствора. Согласно уравнению, увеличение кислотности гидротерм будет вызывать отложение золота. В действительности этот вывод является очень упрощённым: в данных условиях золото может быть отложено также при увеличении рН (рис.1, 2,3). Важным моментом является то, что растворимость золота связана с рН, так как любой процесс, влияющий на рН, может потенциально вызвать отложение золота.
Вторым фактором, который может сместить выше упомянутое уравнение вправо, является удаление H2 S. Наибольший эффект этот процесс даёт в фазу разделения, другими словами, если H2 S отделяется в результате кипения. Однако изменение в бисульфидном равновесии, в результате образования других сульфидов, может быть также важным процессом: отсюда обычное нахождение золота в виде включений в сульфидах. Далее мы более подробно остановимся на этих процессах и их значении.
Третьим процессом, который не отражён в выше приведенном уравнении, является охлаждение: золотосульфидный комплекс имеет прогрессивную растворимость (в интервале эпитермальных температур), так что охлаждение гидротерм будет вызывать отложение этого комплекса.
Другим фактором, который оказывает влияние на отложение золота, является адсорбция другими минеральными фазами. Этот процесс может эффективно извлекать золото из раствора. Некоторые мышьяковистые и другие гели, которые образуются в горячих источниках, могут эффективно участвовать в этом процессе, как и некоторые супергенные окислы и гидроокислы.
2. Механизмы, являющиеся причиной отложения золота
Показав, какие условия могут быть причиной отложения золота, рассмотрим физические процессы, которые происходят в гидротермальной системе и предположительно оказывают воздействие на формирование таких условий. Возникая в некоторых местах гидротермальных систем, они приводят к концентрированным отложениям золота. Главные механизмы описываются в последовательности от менее важных к более важным с точки зрения формирования промышленных месторождений:
Кондуктивное охлаждение. Этот процесс будет вызывать отложение золота, но механизм концентрирования не очень эффективный, так как скорость теплопотерь медленная и, в связи с этим, отложение золота происходит на большой площади. Он может привести к рассеянию золота в результате отложения других минералов, таких как кремнезём.
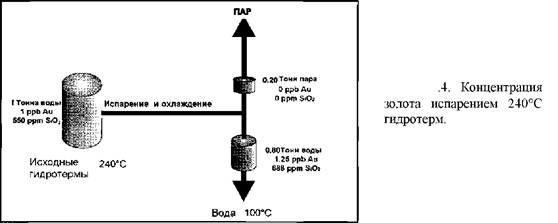
Испарение. Этот процесс более эффективен в качестве концентратора золота в растворе в небольшом масштабе, но не очень эффективен при образовании больших зон концентрированного отложения, поскольку энергетические затраты высокие. Выброс гидротерм при 240°С при падении давления до атмосферного (т.е. до 100°С) будет вызывать повышение концентрации лишь на 1/5 часть, которая приходится на уменьшение объёма гидротерм в виде пара, что слишком незначительно (рис.4). Более продолжительное испарение на поверхности в горячих котлах (прудах) может привести к образованию кремнистых золотосодержащих отложений (гейзерит), но обычно они не имеют промышленного значения. В связи с этим увеличение объёма рудосодержащих минералов может уменьшить содержание золота.
Взаимодействие вода-порода. В большинстве гидротермальных систем гидротермальные растворы не всегда находятся в равновесии с вмещающими породами. В результате гидротермальных изменений наблюдается образование более низкотемпературных и гидратированных фаз, но без значительных изменений химического состава гидротерм при взаимодействии вода-порода. Важным исключением являются месторождения типа Карлин, которые образуются при взаимодействии гидротермальных растворов и карбонатных пород. Оказалось, что в этом случае часть карбонатного вещества помогает отложению золота. Другое исключение относится к системам хай сульфидейшн, где гидротермы имеют другой, более агрессивный состав. Но помимо этих примеров, взаимодействие вода-порода обычно не эффективно при формировании локальных концентрированных золоторудных образовании
Смешение гидротерм. Этот процесс имеет разнонаправленное влияние. Смешение высокотемпературных (горячих) гидротерм с холодными подземными водами будет как разбавлять концентрации золота (ослабляя процесс отложения золота), так и охлаждать горячие гидротермы (повышая вероятность золотого рудообразования). Эффект охлаждения доминирует, но не во всех случаях. Таким образом, этот процесс будет обусловливать частичное отложение золота, но степень концентрации его будет не высокой. Однако изменение рН или концентрирование бисульфидов, вследствие прямого смешения гидротерм или в результате соосаждения с другими минеральными фазами, приводит к концентрированию золота. Особенно важным является процесс, в результате которого вторичные гидротермальные растворы, которые могут иметь высокую кислотность (см. ниже), смешиваются с восходящими струями пара, поднимающимися от первичных субнейтральных гидротерм.
Кипение гидротерм. Этот процесс также разнонаправленный. Эффект концентрации в результате испарения и охлаждения гидротерм приводит к потере их энергии и ускорению отложения золота, хотя влияние этого процесса незначительное. Наибольшее влияние на этот процесс оказывает выделение газов из гидротерм. Удаление 1% воды в виде пара будет сопровождаться потерей гидротермами подавляющей доли растворенного газа (точное количество зависит от температуры и рН гидротерм) (рис.5).

Отделение H2 S вызывает быстрое отложение золота, которое может быть усилено соосажденим других минералов, особенно сульфидов. Ситуация осложняется взаимосвязанными с этим процессом изменениями рН. Влияние дегазации CO2 и H2 S сводится к тому, что гидротермы становятся более щелочными. Этот процесс препятствует отложению золота. Но в целом комбинация этих факторов означает, что отложению золота благоприятствует резко возникшее, обширное и продолжительное кипение. Этот процесс является главной причиной образования промышленных с высокими содержаниями золота эпитермальных месторождений.
3. Кипение и газоотделение
Для понимания флюидных процессов в гидротермальных системах, необходимо изучить происходящие там кипение и дегазацию (газоотделения). Для такого флюида, как вода, при любой конкретной температуре, имеется понятие теоретического давления пара. Это давление, которое будет существовать над свободной водной поверхностью в открытом сосуде. Если такое давление будет меньше, чем давление ограничивающей его жидкости в парообразной фазе, то жидкая фаза будет испаряться до тех пор, пока не будет достигнуто равновесное давление в обеих фазах. В ограниченной системе, в которой паровая фаза может удаляться (если уменьшается ограничительное давление до значений меньше, чем давление насыщенного пара) или увеличивается температура (в том случае, когда давление насыщенного пара больше, чем ограничительное давление), то жидкие гидротермы будут очень быстро (взрывоподобно) превращаться в пар, что определяется словом "флэш". Процесс будет продолжаться до тех пор, пока температура гидротерм упадет до соответствующего (достаточного) значения, при котором давление насыщенного пара будет меньше, чем ограничительное давление, или давление поднимется до значений давления насыщенного пара, или же приток гидротерм прекратится.
Аналогичная ситуация характерна для растворённых газов. Любой конкретной температуре гидротерм соответствует теоретическое давление насыщенных газов. Поскольку водяной пар также присутствует в этом процессе, то это давление называется парциальным давлением газа. Но необходимо помнить, что, за исключением случаев с очень высокими давлением или концентрацией, газы в сосудах действуют независимо. Общее давление представлено суммой парциальных давлений. Таким образом, газ, по существу, игнорирует давление водяного пара. Если ограничительное давление меньше, чем парциальное давление насыщенного газа, то газ будет выходить из раствора. Если парциальное давление газа превышает значения насыщения, то газ будет растворяться в жидкой фазе.
"Дегазация" и "кипение" - это физические аналоги. Они имеют одни и те же причины их протекания, т.е. они обусловлены превышением парциального давления над ограничительным давлением. Упрощенно это можно представить так: "кипение" условно относится к основной фазе (растворителю), а "дегазация" - к подчиненной (второстепенной) фазе ("раствор"). В смеси (растворе) они находятся совместно.
Эпитермальные месторождения, по определению, связаны только с до критическими гидротермами. Критические и над критические температуры (374°С для чистой воды) воды могут существовать лишь в виде единой фазы независимо от давления.
Умозрительно эта фаза обычно рассматривается в качестве пара, но при таких высоких температурах даже жидкая вода имеет свойства, отличные от свойств, характерных для воды в окружающих условиях. Жидкая вода при около критических температурах имеет довольно низкую плотность и особенно низкую вязкость по сравнению с водой, находящейся в окружающих нас условиях, и значительную (повышенную) способность в качестве растворителя. Таким образом, она мобильнее и "агрессивнее" нормальной, известной нам, вода.
В порфировых около магматических средах вода может быть в условиях над критического режима, но отмечается, что критическая точка резко поднимается при повышении концентрации раствора (Рис.6). Таким образом, высокоминерализованные гидротермы, связанные с порфирами, могут находиться в до критическом режиме и подвергаться "кипению" с разделением на две разные фазы при температурах на многие сотни градусов, превышающие критическую температуру воды.
--> ЧИТАТЬ ПОЛНОСТЬЮ <--