Шпаргалка: Физика, основы теории
Основные положения молекулярно-кинетической теории (МКТ) формулируются следующим образом:
1. Любое вещество имеет дискретное (прерывистое) строение. Оно состоит из отдельных частиц (молекул, атомов, ионов), разделенных промежутками.
2. Частицы находятся в состоянии непрерывного хаотического движения, называемого тепловым.
3. Частицы взаимодействуют друг с другом. В процессе их взаимодействия возникают силы притяжения и отталкивания.
Справедливость МКТ подтверждается многочисленными наблюдениями и фактами.
Наличие у веществ проницаемости, сжимаемости и растворимости свидетельствует о том, что они не сплошные, а состоят из отдельных, разделенных промежутками частиц. С помощью современных методов исследования (электронные и ионные микроскопы) получены изображения наиболее крупных молекул.
Броуновское движение и диффузия свидетельствуют о том, что частицы находятся в непрерывном движении.
Наличие прочности и упругости тел, явления смачивания, поверхностного натяжения в жидкостях и т.д. доказывают существование сил взаимодействия между молекулами.
Масса и размеры молекул.
Размер молекул является величиной условной. Его оценивают следующим образом. Между молекулами наряду с силами притяжения действуют и силы отталкивания, поэтому молекулы могут сближаться лишь до некоторого расстояния. Расстояние предельного сближения центров молекул называют эффективным диаметром молекулы. (При этом условно считают, что молекулы имеют сферическую форму.)
С помощью многочисленных методов определения масс и размеров молекул установлено, что за исключением молекул органических веществ, содержащих очень большое число атомов, большинство молекул по порядку величины имеют диаметр 1· 10 - 10 м и массу 1· 10 - 26 кг.
Относительная молекулярная масса.
Относительной молекулярной (или атомной) массой Мr (или Аr ) называют величину, равную отношению массы молекулы (или атома) mо этого вещества к 1/12 массы атома углерода mоС , т.е.
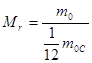
Относительная молекулярная (атомная) масса является величиной, не имеющей размерности.
Количество вещества. Молярная масса. Масса молекулы.
Количеством вещества ν называют величину, равную отношению числа молекул (или атомов) N в данном теле к числу атомов NA в 0,012 кг углерода, т.е. ν = N/ NA (NA - число Авогадро).
Молярной массой М какого-либо вещества называют массу 1 моль этого вещества.
М = mо NA
Следовательно, массу молекулы (атома) можно определить из соотношения
mо = М / NA
13. Идеальный газ. Основное уравнение МКТ идеального газа
Идеальным называют такой газ, при описании свойств которого делают следующие допущения: не учитывают собственный размер газовых молекул и не учитывают силы взаимодействия между ними.
Таким образом, моделью идеального газа является совокупность хаотически движущихся материальных точек, взаимодействующих между собой и со стенками содержащего газ сосуда только при непосредственном столкновении.
Основное уравнение МКТ идеального газа устанавливает зависимость между параметрами молекул и давлением. Давление газа возникает вследствие столкновений молекул со стенками сосуда, в котором находится газ.
Давление идеального газа
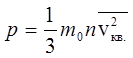
m0 – масса молекулы; n– концентрация молекул, ![]()
![]() - квадрат средней квадратичной скорости молекул.
- квадрат средней квадратичной скорости молекул.![]()
![]()
![]() =
= 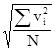
![]()
![]()