Статья: Биосинтез 2Н-меченого бактериородопсина галофильной бактерией Halobacterium halobium
* Московская государственная академия тонкой химической технологии им. М.В. Ломоносова, 117571, Москва, просп. Вернадского, 86;
Осуществлен биосинтез мембранного белка бактериородопсина галофильной бактерией Halobacterium halobium , меченного дейтерием по остаткам [2, 3, 4, 5, 6-2 H5 ]фенилаланина, [3, 5-2 H2 ]тирозина и [2, 4, 5, 6, 7-2 H5 ]триптофана. Комбинацией методов разделения и анализа, включая электрофорез в 12.5% ПААГ с 0.1% ДДС-Na, гель-проникающую хроматографию на сефадексе G-200, обращенно-фазовую ВЭЖХ, спектроскопию 1 Н ЯМР и масс-спектрометрию электронного удара метиловых эфиров N-диметиламинонафталин-5-сульфонильных-производных аминокислот, доказаны гомогенность синтезируемого 2 Н-меченого БР и селективность включения дейтерия в молекулу.
Ключевые слова: Halobacterium halobium; [2, 3, 4, 5, 6-2 H5 ]фенилаланин, [3, 5-2 H2 ]тирозин, [2, 4, 5, 6, 7-2 H5 ]триптофан, 2 Н-меченый бактериородопсин; биосинтез; масс-спектрометрия
ВВЕДЕНИЕ
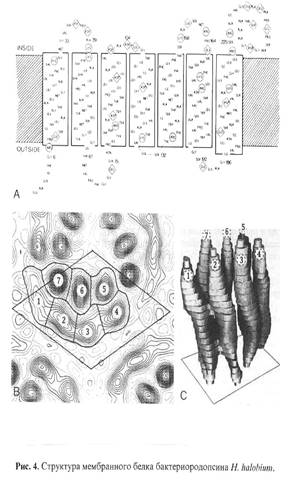
Ретинальсодержащий белок (хромофор - протонированный альдемин ретиналя с e-аминогруппой Lys-216) - бактериородопсин (БR) выполняет функции АТФ-зависимой транслоказы в клеточной мембране галофильных бактерий Halobacterium halobium [1]. Несмотря на его структурно-функциональную изученность, он остается в центре внимания биотехнологии из-за своей высокой светочувствительности и разрешающей способности и используется в прикладных целях как биологический фотохромный материал [2]. БR также привлекателен, как модельный объект для изучения функциональной активности и структурных свойств мембранных белков в составе искусственно сконструированных энергопреобразующих мембран [3].
Для целого ряда структурно-функциональных исследований с БР целесообразно вводить в молекулу белка изотопную метку дейтерия, позволяющую использовать для последующего анализа изотопного включения метод высокочувствительной масс-спектрометрии электронного удара [4, 5]. Поэтому большое научно-прикладное значение имеет БR, меченный дейтерием по остаткам функционально важных ароматических аминокислот - фенилаланина, тирозина и триптофана, участвующих в гидрофобном взаимодействии полипептидной цепи белка с липидным бислоем клеточной мембраны [6]. 2 Н-меченые ароматические аминокислоты могут быть синтезированы с препаративными выходами методом обратного изотопного обмена (1 Н-2 Н) в молекулах протонированных аминокислот - [2, 3, 4, 5, 6-2 Н5 ]фенилаланин в 85% 2 H2 SO4 при 500 C, [3, 5-2 H2 ]тирозин в 6 н. 2 H2 SO4 при слабом кипячении реакционной смеси, [2, 4, 5, 6, 7-2 H5 ]триптофан в 75% 2 H-меченой трифторуксусной кислоте при 250 С [7, 8]. Однако несмотря на изученность современных методов химического синтеза 2 Н-меченых ароматических аминокислот, отечественная индустрия индивидуальных 2 Н-меченых мембранных белков не получила необходимого развития.
В настоящей работе осуществлен биосинтез БР, меченного дейтерием по остаткам [2, 3, 4, 5, 6-2 Н5 ]фенилаланина, [3, 5-2 H2 ]тирозина и [2, 4, 5, 6, 7-2 H5 ]триптофана для реконструкции искусственных мембран с последующим микропрепаративным выделением, а также исследован уровень дейтерированности молекулы БР методом масс-спектрометрии электронного удара метиловых эфиров N-диметиламинонафталин-5-сульфонильных (Днс)-производных аминокислот с обращенно-фазовой ВЭЖХ.
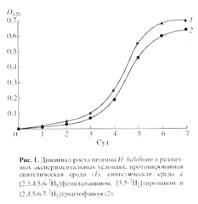
Выбор стратегии биосинтеза 2 Н-меченого БР c использованием штамма экстремальной галофильной бактерии Halobacterium halobium определялся целью исследования, связанной с изучением принципиальной возможности получения 2 Н-меченых препаратов мембранного белка в микропрепаративном количестве для реконструкции искусственных мембран. При выборе [2, 3, 4, 5, 6-2 Н5 ]фенилаланина, [3, 5-2 H2 ]тирозина и [2, 4, 5, 6, 7-2 H5 ]триптофана в качестве источников дейтерия учитывалась их исключительная важность в гидрофобном взаимодействии молекулы БР с лилипидным бислоем клеточной мембраны, устойчивость к реакциям (1 H-2 H) обмена в водной среде в условиях выращивания штамма-продуцента, а также возможность применения метода высокочувствительной масс-спектрометрии электронного удара для последующего анализа. В оптимальных условиях выращивания штамма H halobium (синтетическая среда с 4.3 М NaCl, период инкубации 3-4 сут, 35-370 С при освещении монохромным светом с 560 нм) в клетке синтезировался каротиноидсодержащий фиолетовый пигмент, по спектральному соотношению белкового и хромофорного фрагментов молекулы D280 /D568 1.5:1 идентичный нативному БР. Как показали результаты исследования, рост штамма на синтетической среде (рис. 1, б ) ингибировался незначительно по сравнению с контролем (а ) на протонированной среде, что существенно упрощает оптимизацию условий биосинтеза 2 Н-меченого БР, заключающуюся в эквивалентной замене протонированных ароматических аминокислот среды их дейтерированными аналогами - [2, 3, 4, 5, 6-2 Н5 ]фенилаланином (0.26 г/л), [3, 5-2 H2 ]тирозином (0.2 г/л) и [2, 4, 5, 6, 7-2 H5 ]триптофаном (0.5 г/л).
ОБСУЖДЕНИ Е РЕЗУЛЬТАТОВ
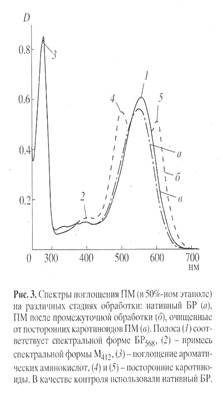
Основными этапами исследования являлись: выращивание штамма экстремальных галофильных бактерий H. halobium на синтетической среде с [2, 3, 4, 5, 6-2 Н5 ]фенилаланином (0.26 г/л), [3, 5-2 H2 ]тирозином (0.2 г/л) и [2, 4, 5, 6, 7-2 H5 ]триптофаном (0.5 г/л), выделение фракции пурпурных мембран (ПМ), отделение от низко- и высокомолекулярных примесей, клеточной РНК, каротиноидов и липидов, фракционирование солюбилизированного в 0.5% ДДС-Na белка метанолом, гель-проникающая хроматография на сефадексе G-200, электрофорез в 12.5% ПААГ с 0.1% ДДС-Na (рис.2). Поскольку белок локализуется в ПМ, освобождение от низкомолекулярных примесей и внутриклеточного содержимого достигали осмотическим шоком клеток дистиллированной водой на холоду после удаления 4.3 М NaCl и последующим разрушением клеточной оболочки ультразвуком при 22 кГц. Последующую обработку клеточного гомогената РНК-азой I (2-3 ед. акт.) проводили для разрушения клеточной РНК. Поскольку фракция ПМ наряду с искомым белком в комплексе с липидами и полисахаридами содержала примесь связанных каротиноидов и посторонних белков, применялись специальные методы фракционирования белка без повреждения его нативной структуры и диссоциации, что существенно усложняло задачу выделения индивидуального БР с применением методов декаротинизации и делипидизации, а также очистки и колоночной хроматографии. Декаротинизация, заключающаяся в многократной обработке ПМ 50% этанолом при -50 С, являлась рутинным, но обязательным этапом, несмотря на значительные потери хромопротеина. Использовалось не менее пяти обработок 50% этанолом, чтобы получить спектр поглощения суспензии очищенных от каротиноидов (4) и (5) ПМ (степень хроматографической чистоты 80-85%), показанного на рис. 3 на различных стадиях обработки (б ) и (в ) относительно нативного БР (а ). Образование ретинальпротеинового комплекса в молекуле БР приводит к батохромному сдвигу в спектре поглощения ПМ (рис. 3, в ) - основная полоса (1) при максимуме поглощения l 568 нм, вызванная световой изомеризацией хромофора по С13=С14-кратной связи определяется наличием транс -ретинального остатка ретиналя БР568 , дополнительная малоинтенсивная полоса (2) при l 412 нм характеризует незначительную примесь образующейся на свету спектральной формы M412 c депротонированной альдиминной связью между остатком транс -ретиналя и белком, а полоса (3) при l 280 нм определяется поглощением ароматических аминокислот в полипептидной цепи белка (для чистого БR соотношение D280 /D568 равно 1.5:1).
Фракционирование и тщательная хроматографическая очистка белка являлись следующим необходимым этапом. Поскольку БР, будучи трансмембранным белком (Мr 26.7 кД), пронизывает билипидный слой в виде семи a-спиралей, применение сульфата аммония и других традиционных высаливающих агентов не дает положительного результата. Решение проблемы заключалось в переводе белка в растворимую форму солюбилизацией в 0.5% ДДС-Na. Использование ионного детергента ДДС-Na диктовалось необходимостью максимальной солюбилизации белка с комбинированием стадии делипидизации и осаждения в нативном виде, поскольку солюбилизированный в слабоконцентрированном растворе ДДС-Na (0.5%) БР, сохраняет спиральную a-конфигурацию [9]. Поэтому отпала необходимость использования органических растворителей ацетона, метанола и хлороформа для очистки от липидов, а делипидизация и осаждение белка совмещались в одну единственную стадию, существенно упрощающую фракционирование. Значительным преимуществом метода является, что целевой белок в комплексе с молекулами липидов и детергента распределяется в надосадочной жидкости, а другие высокомолекулярные примеси - в непрореагировавшем осадке, легко отделяемом центрифугированием. Фракционирование солюбилизованного в 0.5% ДДС-Na белка с его последующим выделением в кристаллическом виде достигали в три стадии дробным низкотемпературным (-50 С) осаждением метанолом, уменьшая концентрацию детергента соответственно в 2.5 и 5 раза. Окончательная стадия очистки БР заключалась в отделении белка от низкомолекулярных примесей методом гель-проникающей хроматографии, для чего БР-содержащие фракции дважды пропускали через колонку с декстрановым сефадексом G-200, уравновешенную 0.09 М Трис-боратным буфером (рН 8.35) с 0.1% ДДС-Na и 2.5 мМ ЭТДА (рис.3). Согласно разработанному методу фракционирования получено 8-10 мг 2 Н-меченого БР из 1 г бактериальной биомассы, гомогенность которого удовлетворяла требованиям, предъявляемым для реконструкции мембран и подтверждалась электрофорезом в 12.5% ПААГ с 0.1% ДДС-Na, регенерацией апомембран с транс -ретиналем и обращенно-фазовой ВЭЖХ метиловых эфиров N-Днс-аминокислот. Небольшой выход БР не был препятствием для последующего масс-спектрометрического анализа, однако здесь необходимо подчеркнуть, что для обеспечения высокого выхода белка необходимо наработать большее количество сырьевой биомассы.
Условия проведения гидролиза 2 Н-меченого БР определялись необходимостью предотвращения реакций изотопного (1 Н-2 Н) обмена водорода на дейтерий в молекуле фенилаланина и сохранения остатков триптофана в белке. Рассматривались два альтернативных варианта - кислотный и щелочной гидролиз. Кислотный гидролиз белка в стандартных условиях (6 н. HСl или 8 н. H2 SO4 , 1100 С, 24 ч), как известно, приводит к полному разрушению триптофана и частичному разрушению серина, треонина и некоторых других аминокислот в белке [10], которые для настоящего исследования не играют существенной роли. Модификация этого метода, заключающаяся в добавлении в реакционную среду фенола [11], тиогликолевой кислоты [12], b-меркаптоэтанола [13], позволяет сохранить до 80-85% триптофана. Использование п-толуолсульфокислоты с 0.2% 3-(2-аминоэтил)-индолом или 3 М меркаптоэтансульфокислоты [14] также эффективно для сохранения триптофана (до 93%) [15]. Однако для решения поставленной задачи вышеперечисленные методы непригодны, поскольку обладают существенным недостатком: в условиях кислотного гидролиза с высокой скоростью происходит изотопный обмен ароматических протонов (дейтеронов) в молекулах триптофана, тирозина и гистидина [16], а также протонов при атоме С3 аспарагиновой и С4 глутаминовой кислот [17]. Поэтому даже проведение гидролиза в дейтерированных реагентах (6 н. 2 HCl, 4 н. 2 H2 SO4 в 2 H2 O) не позволяет получать реальные данные о включении дейтерия в белок.
В условиях щелочного гидролиза (4 н. Ba(OH)2 или 4 н. NaOH, 1100 C, 24 ч) реакций изотопного обмена водорода практически не наблюдается (исключением является протон (дейтерон) у атома С2 гистидина, а триптофан не разрушается, что определило выбор метода гидролиза в настоящей работе. Упрощение процедуры выделения смеси свободных аминокислот за счет нейтрализации серной кислотой явилось причиной выбора в качестве гидролизующего агента 4 н. Ba(OH)2 . Возможная D ,L -рацемизация аминокислот при щелочном гидролизе не влияла на результат последующего масс-спектрометрического исследования уровня дейтерированности молекул аминокислот.
Таблица. Величины пиков (М)+ в масс-спектре электронного удара метиловых эфиров N- Dns-[2, 3, 4, 5, 6-2 H5 ]фенилаланина, N-Dns-[3, 5-2 H2 ]тирозина и N-Dns-[2, 4, 5, 6, 7-2 H5 ]триптофана.
| Соединение | Величина пика (М)+ | Интенсив-ность, % | Количество атомов дейтерия | Уровень дейтерированности, % от общего количества атомов водорода |
| N- Dns-[2, 3, 4, 5, 6-2 H5 ]Phe-Ome |
413 414 415 416 417 418 |
7 18 15 11 14 6 |
1 2 3 4 5 6 |
13 --> ЧИТАТЬ ПОЛНОСТЬЮ <-- К-во Просмотров: 231
Бесплатно скачать Статья: Биосинтез 2Н-меченого бактериородопсина галофильной бактерией Halobacterium halobium
|