Статья: Электрические реакции глаза брюхоногого моллюска Lymnaea stagnalis L.
Микроэлектродное исследование глаза Lymnaea stagnalis выявило два типа электрических сигналов: постоянный потенциал и его изменения в ответ на световую стимуляцию (ЭРГ). Установлено, что полярность фаз ЭРГ не зависит от точки на поверхности глазного бокала, в которой производилось погружение микроэлектрода в сетчатку. Сравнение динамики компонентов ЭРГ позволяет сделать предположение об их различном происхождении, а также о существовании профиля полярности и амплитуды ЭРГ по толщине сетчатки.
Введение
Камерный глаз брюхоногих моллюсков сравнительно редко выступает объектом электрофизиологических исследований. Можно указать лишь на небольшое число работ, в которых производилась регистрация электроретинограммы (ЭРГ) или электрических ответов фоторецепторных клеток сетчатки глаза морских и сухопутных видов [1]. Поэтому логичной кажется постановка такой экспериментальной задачи по отношению к глазу пресноводного легочного моллюска. Объектом настоящей работы был выбран большой прудовик Lymnaea stagnalis. Камерный глаз этого моллюска имеет строение, типичное для брюхоногих, и включает в себя роговицу, хрусталик, стекловидное тело и однослойную сетчатку с микровиллярными фоторецепторными клетками [2]. Особенностью строения является геометрия сетчатки, внутренняя поверхность которой образует характерные углубления – дорсальную и более глубокую вентральную ямки [3].
Ранее была описана ЭРГ, полученная всасывающим электродом в области основания глазного бокала в месте формирования оптического нерва [4]. В данной работе производилась микроэлектродная регистрация электрических сигналов глаза в различных топографических точках. При этом ставилась цель – получить представление о пространственном распределении электрических потенциалов в глазном бокале в условиях темновой адаптации и при генерации ответа на световую стимуляцию.
Материалы и методы
Объект исследования. Взрослые особи Lymnaea stagnalis L. с раковиной высотой 2 см были собраны прудах Калининграда и содержались в емкостях с отстоянной водопроводной водой. Световой режим 12 С : 12 Т устанавливали лампами накаливания.
Препарат. Глаз размером около 300 мкм по продольной и 200 мкм по поперечной оси с обрубком оптического нерва длиной около 700 мкм выделяли под красным светом (фильтр КС-10).
Препарат изолированного глаза фиксировали в экспериментальной камере за отходящие от него пучки коллагеновых волокон вольфрамовыми иглами, заточенными электролитически. При этом апертурное отверстие глаза ориентировали навстречу стимулирующему световому потоку.
Физиологический раствор (мМ): NaCl – 40; KCl – 3; CaCl2 – 3; MgCl2 – 1; рН = 7,5 поддерживали карбонатным буфером [5].
Электрофизиологическая установка. Эксперименты проводились в электрофизиологической установке, состоящей из измерительного комплекса для работы с микроэлектродами, цифрового осциллографа С9-8 и чернильного графопостроителя Н306.
Световая стимуляция осуществлялась источником света (лампа КГМ-150) с регулируемым накалом. Световые стимулы продолжительностью 0,5 с формировали электромеханическим затвором, которым управляли электронным стимулятором ЭС-50 – 1. После прохождения абсорбционных фильтров (ФИ-05) световой пучок по оптоволоконному кабелю направляли к препарату и фокусировали на нем.
Микроэлектроды с диаметром кончика менее 1 мкм изготавливали на горизонтальной кузнице Leitz. Электроды заполняли 3 М раствором KCl. Сопротивление микроэлектродной системы в физиологическом растворе было около 15 – 20 МОм и контролировалось перед каждым погружением микроэлектрода.
Ход эксперимента. Позиционирование микроэлектрода проводили при красном свете, подаваемом через световолоконный жгут, снабженный фильтром КС-10. После темновой адаптации длительностью 30 мин осуществляли погружение микроэлектрода до появления устойчивой разности потенциалов и проводили контрольное освещение препарата. Если ответа не было, погружение продолжали.
В ходе каждого эксперимента производили серию последовательных регистраций вдоль длинной оси глазного бокала, начиная от края роговицы и до окончания области нейропиля. Точки отведения на разных препаратах выбирали визуально – ориентируясь относительно границ пигментного слоя глазного бокала. С достаточной уверенностью удалось идентифицировать три основные точки отведения потенциала (рис. 1, 2). Для каждой точки проводили последовательно три – четыре

![]()

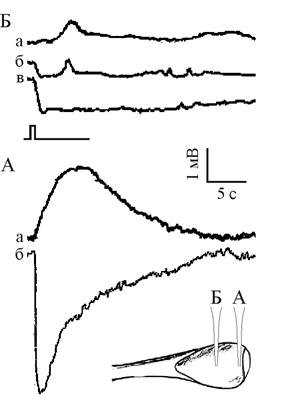
Рис. 1. Примеры ЭРГ, полученные микроэлектродным отведением
в области роговицы (а) и средней части глазного бокала Lymnaea stagnalis (б). Точки погружения микроэлектрода показаны на вставке.
Отметка стимуляции общая для всех приведенных ЭРГ
электрических ответа на световую стимуляцию. В связи с тем, что длительность регистрации электрических потенциалов глаза была ограничена (сеанс регистрации из каждой точки, как правило, не превышал 20 – 30 мин), отведения от всех трех точек получены не для каждого препарата. Но на 12 препаратах удалось провести во всех точках весь набор отведений. Всего было исследовано 72 препарата и произведено 229 записей ЭРГ.

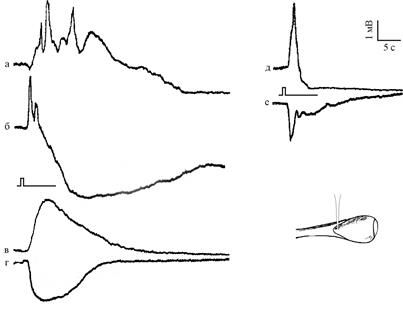
Рис. 2. Примеры ЭРГ, полученные микроэлектродным отведением
в области нейропиля глазного бокала Lymnaea stagnalis.
Место погружения микроэлектрода указано на вставке.
Для каждого столбца записей показана общая отметка стимуляции
Результаты
Было зарегистрировано два вида электрических сигналов: постоянный потенциал (ПП) положительного или отрицательного знака относительно индифферентного электрода и его быстрые изменения в ответ на световую стимуляцию – ЭРГ, которая могла состоять из одного или нескольких медленных компонентов (волн) и более быстрых пиков. Употребляемая при описании ЭРГ терминология – отрицательный или положительный компонент (волна или пик) – относится к направлению смещения потенциала во время ответа относительно исходного ПП. Ниже следует описание ответов, полученных в различных точках глазного бокала.
Область роговицы. При проколе микроэлектродом в районе роговицы фиксировали положительный ПП амплитудой до 12 мВ. Волна ЭРГ с равной вероятностью могла иметь как положительную (амплитуда до 3 мВ, рис 1а 1), так и отрицательную (амплитуда до 10 – 11 мВ, рис. 1а 2) полярность. Фаза реполяризации более медленная, чем соответствующий компонент ЭРГ в нейропиле. Погружение электрода приводит к увеличению положительного значения потенциала. Быстрых изменений потенциала на фоне развивающейся ЭРГ, характерных для области нейропиля, зафиксировано не было. Зарегистрированная в этой области форма ЭРГ была наиболее стабильной по сравнению с отведениями в других точках: со временем наблюдалось лишь изменение амплитуды при сохранении направления и динамики фаз. В этой точке была получена 61 ЭРГ.
Средняя часть глазного бокала. При проколе бокала регистрировали небольшой положительный ПП до двух мВ, который при длительном нахождении электрода в этой точке мог падать до нуля. ЭРГ, полученные в этих точках, имели вид волн, среди которых встречались как положительные, так и отрицательные. Были зарегистрированы двух- и трехфазные волны ЭРГ (рис. 1б 1 – 3) При дальнейшем погружении микроэлектрода ПП падал до нулевого значения, вместе с тем уменьшалась и амплитуда ЭРГ без заметного искажения фаз. В этой части бокала было получено 69 ЭРГ.
Нейропиль. На первых этапах погружения электрода в глазной бокал наблюдался отрицательный ПП величиной до 10 мВ. В этой точке регистрировали ЭРГ, по крайней мере, трех видов.
1. Отрицательная монофазная волна амплитудой до 7 мВ, состоящая из относительно быстрого смещения потенциала и более медленного его возврата к исходному значению (реполяризация) (рис. 2 4). Такой вид имели около 45 % из 99 зарегистрированных в этой точке ЭРГ.
2. В стольких же случаях регистрировали сходную по кинетике положительную волну ЭРГ амплитудой до 8 мВ (рис. 2 3).
--> ЧИТАТЬ ПОЛНОСТЬЮ <--