Статья: Эмбриональные стволовые клетки человека
Эмбриональные клетки мыши легко дифференцируются в кардиомиоциты. Всего через несколько дней после удаления питательного слоя и фактора LIF, поддерживающего недифференцированное состояние клеток, на культуральных чашках образуются сокращающиеся колонии клеток. В определенных условиях они имеют электрофизиологию нормальных взрослых кардиомиоцитов и, более того, могут функционально интегрироваться в мышцу миокарда. В отличие от мышиных клеток, спонтанная дифференцировка клеток человека наблюдается у разных линий ЭСК - от сокращающихся участков в 70% эмбриоидных телец до полного отсутствия дифференцировки. Предшественники кардиомиоцитов, полученные из ЭСК человека, синтезируют транскрипционные факторы Nkx 2.5, GATA4, а затем и специфические маркеры кардиомиоцитов (тропонин 1 и тяжелую цепь -миозина). Мы наблюдали спонтанную дифференцировку ЭСК в кардиомиоциты в двух линиях из трех, причем сокращающиеся участки отмечались в очень небольшом проценте эмбриоидных телец.
Клетки гемопоэтического ряда впервые получили при совместном культивировании ЭСК человека с линиями стромальных фибробластов, а также используя факторы роста гематопоэтических клеток. В эмбриоидных тельцах обнаружена также популяция клеток, обладающих свойствами предшественников гематопоэтических клеток и эндотелиальных (гемангиобласт).
В нашей лаборатории ведутся работы по прямой (т.е. минуя стадию эмбриоидных телец) дифференцировке ЭСК человека в клетки эндотелия и разрабатываются методы их селекции. Используя коллагены в качестве матрикса, специальную среду и ростовые факторы, мы получили клеточные популяции, в которых эндотелиальные клетки составляют около 50%. На коллагеновом матриксе они образуют капилляроподобные структуры, несущие специфические маркеры сосудистого эндотелия (рис.3). Мы успешно применяли метод иммуномагнитной селекции СD31-положительных эндотелиальных предшественников на ранних (4-5-й день) этапах дифференцировки, поскольку на поздних этапах межклеточные контакты в капилляроподобных структурах с трудом поддаются энзиматическому расщеплению и клетки теряют жизнеспособность. В результате селекции нам удавалось выделить гомогенную популяцию эндотелиальных клеток, in vitro формирующих капилляроподобные структуры.
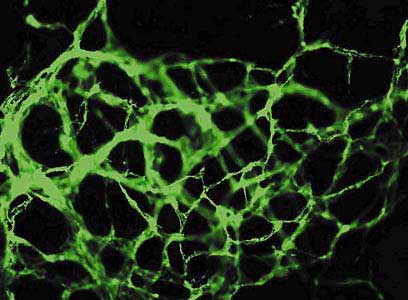
Рис. 3. Эндоваскулярная сеть, образованная in vitro чистой выделенной популяцией клеток эндотелия,
полученных методом иммуномагнитной сепарации из ЭСК человека (окрашена на маркер CD31). Увел. 200.
Труднее всего оказалось с производными энтодермы. Несмотря на опубликованные сообщения о дифференцировке ЭСК человека в инсулин-секретирующие клетки и гепатоциты, их функциональность не показана. Более того, по белковым и генетическим маркерам они не полностью совпадают с зрелыми инсулин-секретирующими клетками или гепатоцитами. Пока неизвестны факторы, определяющие преобразование в энтодерму, и маркеры ранней энтодермальной дифференцировки.
Итак, сегодня ясно, что для наработки массы клеток разных типов уже имеется разработанная модель дифференцировки, которая должна соответствовать определенным требованиям:
- эмбриональные стволовые клетки нужно культивировать в стандартизованных условиях с отработкой генетических манипуляций и соблюдением технологии клонального роста;
- индуцированную дифференцировку необходимо вести преимущественно к желаемому клеточному фенотипу и иметь возможность селекции нужных популяций клеток;
- все этапы дифференцировки должны быть воспроизводимы и контролируемы, а действие факторов, ее индуцирующих, хорошо известно;
- желательно также избегать многокомпонентных нестандартизованных факторов, таких как сыворотка, кондиционированная среда, клеточные экстракты и т.д.
Таковы научно-технологические аспекты разработки клеточных технологий на основе ЭСК человека. Одновременно с этим существует целый ряд этических проблем, связанных с исследованием и применением человеческих ЭСК.
Вокруг линий ЭСК человека продолжаются бесконечные дебаты, касающиеся моральной стороны проблемы, а именно возможного использования невостребованных бластоцист для выделения ЭСК. Ответа на этот вопрос до сих пор нет. Здесь хочется привести высказывание известного ученого в области раннего эмбрионального развития профессора В.Рейка: «Пока с помощью этой технологии кого-нибудь не спасут, разговоры об этичности и запреты на исследования не прекратятся».
Стремительное развитие исследований в области стволовых клеток человека стимулировало штат Калифорния принять Предложение 71 о выделении 3 млрд долл. на 10 лет для получения новых клеточных линий ЭСК. В мае 2005 г. Национальная академия наук США призвала к добровольному принятию этических правил в области исследования ЭСК человека. Эти правила касаются информированного согласия доноров, запрещения оплаты донорского материала, работы банков ЭСК, создания наблюдательных комитетов. Все 23 предложенных правила приняты к исполнению академическими и научными организациями штата Калифорния, вовлеченными в работу с ЭСК человека. Чуть позже FDA (Food and Drug Administration) издала инструкцию по скринингу и тестированию доноров человеческих клеток, тканей и продуктов, основанных на клетках. В некоторых странах Европейского сообщества в течение 2004-2005 гг. принят ряд законов, разрешающих исследования в области ЭСК человека.
Уже активно обсуждаются правила проведения первой фазы клинических испытаний на основе клеток, полученных из ЭСК человека. При этом преследуется основная цель - не навредить будущему реципиенту, поскольку эти трансплантаты существенно отличаются от традиционных. Во-первых, значительный период проходит между получением биологического материала и его применением. За это время могут обнаружиться новые заболевания доноров или те, которые не смогли определить при получении биологического материала. Кроме инфекционных, с течением времени у доноров клеточного материала могут проявиться генетические заболевания, в том числе такие, как наследственная предрасположенность к раку. Более того, применение иммуносупрессоров при трансплантации реципиентам аллогенного материала повышает риск онкологических и инфекционных заболеваний. И, наконец, если пересадка материала, полученного на основе ЭСК человека, окажется эффективной, то материал единичных линий будет применяться для большого количества пациентов. Поэтому одной из основных этических проблем, ожидающих клеточную терапию на основе ЭСК человека, будет проблема повторного контакта и обследования доноров биологического материала. Таким образом, развитие клеточных технологий на основе аллогенного материала, в том числе и ЭСК, приводит к новым вопросам этического характера, разрешить которые необходимо до начала клинических испытаний.
Итак, сегодня рано говорить о применении клеточных имплантатов, полученных на основе ЭСК человека. Остается слишком много нерешенных задач, главные из которых заключаются в безопасности использования таких имплантатов. Их реальную эффективность и безопасность можно будет оценить лишь после проведения длительных и тщательных клинических испытаний. Тем не менее, по оценке многих зарубежных консалтинговых компаний, технологии на основе ЭСК будут применяться в клинике уже на рубеже 2012-2015 гг.
Список литературы
1. Thomson J.A., Itskovitz-Eldor J., Shapiro S.S. et al. // Science. 1998. V.282. №5391. P.1145-1147.
2. Pera M.F., Trounson A.O. // Development. 2004. V.131. №22. P.515-525.
3. Reubinoff B.E., Pera M.F., Fong C.Y. et al. // Nat. Biotechnol. 2000. V.18. №4. P.399-400.
4. Niwa H., Miyazaki J., Smith A.G. // Nat. Genet. 2000. V.24. №4. P.328-330.
5. Reubinoff B.E., Itsykson P., Turetsky T. et al. // Nat. Biotechnol. 2001. V.19. №12. P.1134-1140.