Статья: Физиологическая адаптация нового RuMP штамма факультативных метилотрофных бактерий Brevibacterium methylicum к тяжелой воде
БИОТЕХНОЛОГИЯ
Физиологическая адаптация нового RuMP штамма факультативных метилотрофных бактерий Brevibacterium methylicum к тяжелой воде
@ 2006 О. В. МОСИН
Московская государственная академия тонкой химической технологии им. М.В. Ломоносова, 117571, Москва, просп. Вернадского, 86.
Разработан метод физиологической адаптации нового фенилаланин-продуцирующего RuMP штамма факультативных метилотрофных бактерий Brevibacterium methylicum к максимальным (98 об.%) концентрациям 2 Н2 О с целью последующего микробиологического синтеза 2 Н-меченого фенилаланина. Метод заключается в последовательном рассеве штамма на агаризованных средах М9 с 2 об.% [U -2 Н] MetOH со ступенчато возрастающим градиентом концентрации 2 Н2 O (от 0 до 98 об.% 2 Н2 О) и последующей селекцией колоний по признаку устойчивости к 2 Н2 О. В результате применения разработанного подхода для данного штамма метилотрофных бактерий на среде с 98 об.% 2 H2 О были отобраны отдельные колонии, сохранившие высокие ростовые и биосинтетические параметры. За счет использования адаптированного штамма можно получить 0.95 грамм 2 Н-меченого фенилаланина с 1 литра ростовой среды. Показано, что наряду с фенилаланином штамм синтезирует и выделяет в ростовую среду в количестве 5-6 ммоль метаболически связанные с ним аминокислоты: аланин, валин и лейцин/изолейцин. Согласно данным метода масс-спектрометрии EI MS метиловых эфиров N-диметиламинонафталин-5-сульфонильных (Dns) производных аминокислот, 2 Н-меченые аминокислоты, полученные микробиологическим синтезом представляли собой смеси молекул с различным количеством включенных атомов дейтерия; уровень дейтерированности молекул определяли из масс-спектров по наиболее распространенному пику молекулярного иона (M)+ каждой аминокислоты - для фенилаланина уровень дейтерированности составил 6; для аланина -3.1; для валина -4.7; для лейцина/изолейцина - 5.1 атома дейтерия.
ВВЕДЕНИЕ
В настоящее время микробиологический синтез 2 Н-меченых аминокислот привлекает все большее внимание исследователей вследствие исключительно природной конфигурации синтезируемых соединений, возможностью униформного введения дейтериевой метки в молекулы аминокислот и их низкой стоимости по сравнению с химически синтезированными аналогами [1, 2]. Именно поэтому поиск новых штаммов-продуцентов 2 Н-меченых аминокислот,устойчивых к высоким концентрациям дейтерия в ростовых средах для их дальнейшего микробиологического использования является актуальной задачей для современной микробиологической промышленности.
С развитием новых биотехнологических подходов появилась возможность использовать для направленного синтеза 2 Н-меченых аминокислот биологическую конверсию [U- 2 H]MetOH в клетках полученных за счет мутагенеза и генной инженерии штаммов метилотрофных бактерий, ассимилирующих MetOH в качестве источника углерода и энергии по рибулозомонофосфатному (RuMP) или сериновому пути ассимиляции углерода [3]. Продуктивность метилотрофных бактерий, измеренная по уровню конверсии MetOH в клеточные компоненты достигает 50%, что делает их удобными объектами для получения с их помощью 2 Н-меченых аминокислот [4]. Традиционным подходом при этом остаётся выращивание метилотрофных штаммов-продуцентов аминокислот на минеральных средах с [U- 2 Н]MetOH и максимальными концентрациями 2 Н2 О [5]. Однако подобные процессы пока не находят широкого применения в микробиологической промышленности, вследствие значительного негативного биостатического эффекта, оказываемого 75-80 об.% 2 Н2 О на рост многих метилотрофов [6], в то время как растительные клетки могут нормально развиваться при концентрациях не более 50 об.% 2 H2 О [7], а клетки животных не более 35 об.% 2 H2 О [8]. Как было показано нами раннее, частично снизить негативный биостатический эффект 2 Н2 О у метилотрофов позволяет предварительная клеточная адаптация к 2 Н2 О и последующее использование для микробиологического синтеза 2 Н-меченых аминокислот адаптированных форм метилотрофных бактерий [9]. Явление клеточной адаптации к 2 H2 О интересно не только само по себе, но оно также позволяет получать уникальный биологический материал, несущий дейтериевую метку, очень удобный для разнопрофильных микробиологических исследований. В соответствиие с этим, целью настоящей работы было исследование процесса физиологической адаптации нового фенилаланин-продуцирующего RuMP штамма факультативных метилотрофных бактерий Brevibacterium methylicum к максимальным (98% об.) концентрациям 2 Н2 О в ростовой среде. Поскольку биосинтетический потенциал данного метилотрофного штамма при росте на 2 Н2 О к началу проведения работы был изучен недостаточно, представляло интерес исследование его способности к микробиологическому синтезу 2 Н-меченого фенилаланина и других аминокислот в условиях максимально насыщенной дейтерием среды.
ОБЪЕКТ ИССЛЕДОВАНИЯ И МЕТОДЫ
Объектом исследования служил полученный за счет мутагенеза нитрозогуанидином лейцинзависимый грам-положительный штамм RuMP факультативных метилотрофных бактерий Brevibacterium methylicum ВКПМ В 5652, продуцентфенилаланина [10]. Потребость штамма в лейцине составляет 10 мг/л. Родительский штамм был получен из Всероссийской коллекции промышленных микроорганизмов (ВКПМ) Государственного научно-исследовательского центра генетики и селекции промышленных микроорганизмов ГНИИГЕНЕТИКА.
Для приготовления ростовых сред и адаптации штамма использовали 2 H2 O (99.9 ат.% 2 H) и [U- 2 Н] MetOH (97.5 ат.% 2 H), полученные из Российского научно-исследовательского центра ИЗОТОП (Санкт-Петербург, РФ). Для создания высокого градиента концентрации 2 Н2 О в ростовых средах использовали 2 Н2 О с атомным содержанием дейтерия 99.9%. Фосфатсодержащие соли были дважды перекристаллизованы в абсолютной 2 Н2 О перед их использованием и высушены в вакууме. Тем не менее, процент дейтерированности ростовых сред после стериллизации влажным паром, измеренный методом ЯМР был ниже на 8-10% изотопной чистоты исходной 2 Н2 О). По необходимости 2 H2 O очищали от вредных примесей, перегоняя её над перманганатом калия [11].
Выращивание штамма проводили в минеральной среде M9 [12], приготовленой на основе различных концентраций 2 Н2 О (см. таблицу) с добавками протонированного лейцина и [U-2 H] MetOH при 370 С в колбах Эрленмейера вместимостью 250 мл с наполнением средой до 50 мл в условиях интенсивной аэрации по методике [13]. После 6-7 суток роста клетки отделяли центрифугированием (10000 об/мин, 20 мин). В культуральной жидкости анализировали секретируемые аминокислоты.
Адаптацию штамма к 2 Н2 О проводили на агаризованных средах М9 (2%-ный агар), содержащих ступенчато возрастающий градиент 2 Н2 О (от 0 вплоть до 98 об.% 2 Н2 О). При этом использовали последовательный рассев штамма до отдельных колоний и последующую селекцию колоний, выросших на средах со ступенчатом градиентом 2 Н2 О. Отобранный штамм хранили в 50%-ном растворе (в 2 Н2 О) глицерина при -140 С.
Морфологию клеток исследовали с помощью интерференционно-поляризационного микроскопа МБР-5 (Венгрия).
Бактериальный рост оценивали по величине оптической плотности суспензии клеток, измеренной на спектрофотометре Beckman-DU6 (США) при 540 нм в кварцевой кювете с длиной оптического пути 10 мм.
Тонкослойную хроматографию (ТСХ) аминокислот проводили на пластинках Silufol UV-254 (Чехо-Словакия) в системе растворителей: изо-PrOH-аммиак, (7:3).
Секретируемый фенилаланин определяли на приборе Beckman DU-6 (США) при 540 нм в образцах культуральной жидкости, объёмом 10 мкл после ее обработки 0.1% раствором нингидрина в ацетоне.
Уровни включения дейтерия в молекулы аминокислот определяли методом масс-спектрометрии EI MS в виде метиловых эфиров N-Dns-производных аминокислот на приборе MB-80A (Hitachi, Япония) при ионизирующем напряжении 70эВ, используя прямую дериватизацию лиофилизированных культуральных жидкостей дансилхлоридом и диазометаном [14].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Выращивание штамма на 2 Н2 О-содержащих средах .
Для выращивания штамма был выбран ступенчато-увеличивающийся градиент концентрации 2 H2 О в ростовых средах в присутствии 2 об.% [U -2 H] MetOH, так как предпологалось, что постепенное привыкание клетки к 2 Н2 О будет оказывать благоприятный эффект на параметры роста и общее самочувствие культуры (таблица). Для компенсации ауксотрофности по лейцину эту аминокислоту добавляли в ростовую среду в протонированном виде в концентрации 10 мг/л. Сначала исходный штамм выращивали на 2 Н2 О-содержащих средах без его предварительной адаптации к 2 Н2 О, для того чтобы определить его ростовые и биосинтетические параметры на этих средах. При росте исходного штамма на контрольной среде с обычной водой продолжительность лаг-фазы и время клеточной генерации составили 20 и 2.2 ч соответственно (таблица, опыт 1). В промежуточных экспериментах эти параметры изменялись пропорционально концентрации 2 Н2 О. В частности, продолжительность лаг-фазы и время клеточной генерации увеличивались, а рост и уровень накопления фенилаланина уменьшались, причем самые низкие значения были зафиксированы на максимально дейтерированной среде с 98 об.% 2 Н2 О. Так, в эксперименте (5), таблица, выход микробной биомассы был снижен в 3.3, а уровень накопления фенилаланина в ростовой среде в 2.7 раз по сравнению с контролем, поэтому было необходимо проводить адаптацию штамма к 2 Н2 О.
Таблица. Изотопный состав ростовых сред и параметры бактериального роста исходного штамма
Компоненты среды, об.% H2 O 2 H2 O MetOH [U -2 H] MetOH |
лаг- фаза (ч) | Выход биомассы((%) |
Время генерации (ч) |
Максимальный уровень накопления фенилаланина в ростовой среде (%) | ||||
| (1) | 98 | 0 | 2 | 0 | 20 | 100.0 | 2.2 | 100.0 |
| (2) | 73.5 | 24.5 | 0 | 2 | 34 | 85.9 | 2.6 | 97.1 |
| (3) | 49.0 | 49.0 | 0 | 2 | 44 | 60.5 | 3.2 | 98.8 |
| (4) | 24.5 | 73.5 | 0 | 2 | 49 | 47.2 | 3.8 | 87.6 |
| (5) | 0 | 98.0 | 0 | 2 | 60 | 30.1 | 4.9 | 37.0 |
Клеточная адаптация к 2 Н2 О .
Специальный подход по адаптации заключался в серии из четырех адаптационных пассажей исходной культуры на твёрдых агаризованных средах с 2 об.% [U-2 H] MetOH с 0, 24.5, 49, 73.5 и 98 об.% 2 Н2 О. При этом отбирали отдельные колонии, выросшие на средах с низкими концентрациями 2 Н2 О. Затем их последовательно пересевали на среды с большей концентрацией 2 Н2 О, включая среду с 98 об.% 2 H2 О, проводя их параллельные контрольные рассевы на протонированной среде (степень выживаемости бактерий составила не более 40%).
За ходом адаптации следили по изменениям продолжительности лаг-фазы, времени клеточной генерации и выходов микробной биомассы, а также по максимальному уровню накопления фенилаланина в ростовой среде (рис. 2). Так, выход микробной биомассы, время клеточной генерации и уровень накопления фенилаланина в ростовой среде при росте адаптированного к 2 Н2 О штамма в 98 об.% 2 Н2 О изменяются по сравнению с контрольными условиями на 13, .. и 5%, т. е. незначительно (рис. 2, опыт 5’). Продолжительность времени генерации существенно не отличается от исходного штамма на Н2 О-среде. Адаптированные к 2 Н2 О клетки сохранили способность синтезировать и экзогенно продуцировать фенилаланин в ростовую среду, который можно выделять в количестве 0.95 г/л.
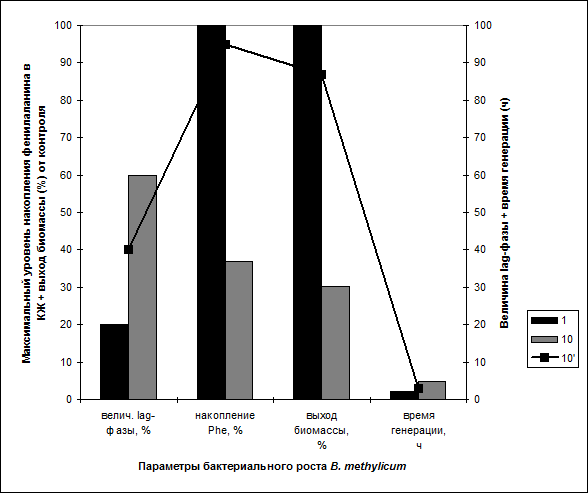
Рис.1
Изучение продукции фенилаланина на 2 Н2 О-содержащих средах .
Во всех экспериментах не зависимо от присутствия 2 Н2 О в ростовой среде было зафиксировано увеличение продукции фенилаланина на ранней фазе экспоненциального роста, когда выход микробной биомассы был незначителен, в то время как на фазе позднего экспоненциального роста наблюдалось снижение уровня его накопления в ростовой среде (рис. 3). Для того чтобы объяснить эффект снижения уровня накопления фенилаланина были высказаны возможные предположения о морфологической неоднородности микробной популяции, ингибировании биосинтеза фенилаланина конечным продуктом нарушении транспорта фенилаланина через клеточную мембрану. Результаты по микроскопическому исследованию растущей популяции микроорганизмов показали, что данный характер динамики накопления фенилаланина не коррелировал с качественными изменениями клеточной морфологии на поздних стадиях роста, что служило подтверждением морфологической однородности микробной популяции. Скорее всего, накопленный экзогенно в процессе роста фенилаланин ингибировал ферменты собственного пути биосинтеза. Кроме того, не исключена возможность, что при выращивании без рН-статирования может происходить как обратное превращение секретируемого фенилаланина в интермедиаторные соединения его биосинтеза по пути шикимовой кислоты, так и спонтанная ассимиляция фенилаланина клеткой для обеспечения своих собственных метаболических потребностей, что отмечено в других работах [15, 16]. Эффект уменьшения уровня накопления фенилаланина наблюдался при росте как на протонированной, так и на среде с 98 об.% 2 Н2 О, что затрудняло его исследование (рис. 3). Из-за того, что на среде с 98 об.% 2 Н2 О ухучшались все ростовые параметры, было сделано предположение, что уменьшение уровня накопления фенилаланина в ростовой среде относится не к изменению транспорта фенилаланина через клеточную мембрану, а к негативному биостатическому эффекту 2 Н2 О. Данные по исследованию культуральной жидкости методом ТСХ показали, что кроме фенилаланина данный штамм синтезирует и накапливает в ростовой среде незначительные количества (на уровне 5-6 ммоль) метаболически связанных с ним аминокислот (аланин, валин, лейцин/изолейцин), присутствие которых также подтверждалось анализом смеси метиловых эфиров N-DNS-производных аминокислот методом масс-спектрометрии EI MS.
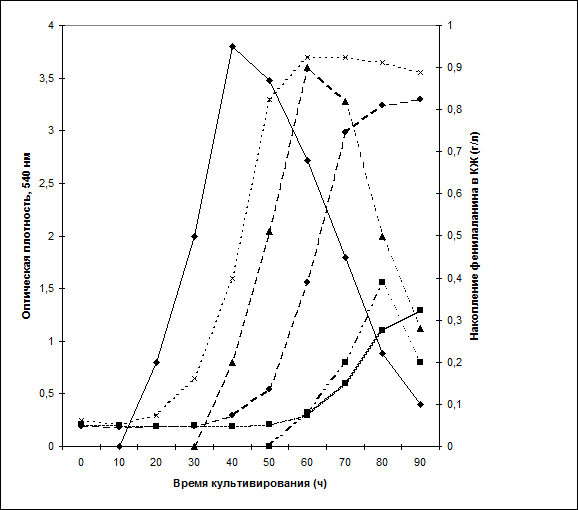
Рис.2.
Изучение уровней включения дейтерия в молекулы аминокислот .
В настоящей работе уровни включения дейтерия в молекулы аминокислот определяли методом масс-спектрометрии EI MS в виде метиловых эфиров N-Dns-производных аминокислот, за счет сопоставления молекулярных масс протонированных и 2 Н-меченых производных аминокислот.
Полученные микробиологическим синтезом 2 Н-меченые аминокислоты представляли собой смеси изотопнозамещённых форм молекул, различающихся количеством атомов водорода, замещённых на дейтерий. Вследствие этого эффекта пики молекулярных ионов метиловых эфиров N-Dns-аминокислот в масс-спектрах были полиморфно расщеплены на кластеры за счет примеси молекул с отношениями m/z , больше или меньше детектируемых прибором величин (М)+ с различным вкладом в суммарный уровень дейтерированности. В качестве примера на рис. 4, б приведен масс-спектр смеси метиловых эфиров N-Dns-производных аминокислот полученных со среды с 98 об.% 2 Н2 О (масс-спектр приведен относительно контрольных условий (а) на обычной воде). Подсчет уровня дейтерированности молекул аминокислот проводили по величине самого интенсивного пика молекулярного иона (М)+ , зарегистрированного самим масс-спектрометром; для фенилаланина - шесть (М+ при m/z 418 вместо М+ при m/z 412 для протонированного метилового эфира N-Dns-фенилаланина), для аланина -3.1 (М+ при m/z 339.5 вместо М+ при m/z 336.4), для валина -4.7 (М+ при m/z 369.2 вместо М+ при m/z 364.5), для лейцина/изолейцина -5.1 атома дейтерия (М+ при m/z 383.6 вместо М+ при m/z 378.5). Таким образом, общее количество дейтерия в молекуле фенилаланина составило 75%, аланине -77.5%, валине -58.8%, лейцине/изолейцине 51%. Уровни дейтерированности 2 Н-меченых аминокислот семейства лейцина должны быть ниже остальных вследствие того что лейцин добавляли в ростовую среду в протонированном виде, что подтвердилось экспериментальными данными (см. выше). В то же время биосинтез фенилаланина был косвенно связан с ауксотрофностью по лейцину, поэтому дейтеривая метка в молекуле самого фенилаланина также была несколько разбавлена.
--> ЧИТАТЬ ПОЛНОСТЬЮ <--