Статья: Характеристики и свойства истинных растворов
Растворение – процесс обратимый: в зависимости от условий происходит или растворение, или выделение из раствора растворенного вещества. Вследствие обратимости процесса растворения к нему применим принцип Ле Шателье. Если растворение вещества происходит с поглощением теплоты, то повышение температуры приводит к увеличению растворимости. Наоборот, если при растворении вещества теплота выделяется, то повышение температуры приведет к уменьшению растворимости. В большинстве случаев растворимость солей возрастает с повышением температуры, для одних умеренно (NaCl), а для других весьма сильно (KNO3, AgNO3), и лишь в отдельных случаях растворимость уменьшается.
Насыщенным называется раствор, находящийся в равновесии с твердой фазой растворенного вещества и содержащий максимально возможное при данных условиях его количество (имеет место динамическое равновесие).
Раствор, концентрация которого ниже концентрации насыщенного раствора, называется ненасыщенным. В таком растворе можно при тех же условиях растворить дополнительное количества вещества. Существуют и пересыщенные растворы, которые содержат вещества больше, чем это следует из его растворимости при данных условиях (получаются путем охлаждения растворов, полученных при более высоких температурах. Такие растворы метастабильны. «Затравки» в виде кристаллов или потирание стеклянной палочки о стенку сосуда вызывают бурную кристаллизацию вещества).
Растворы, содержащие большое количество растворенного вещества, называются концентрированными, а с малым содержанием растворенного вещества – разбавленными.
Способы выражения состава растворов
Массовая доля – отношение (обычно процентное) массы растворенного вещества к массе раствора. Например, 15% (масс.) водный раствор NaCl на 100 единиц массы содержит 15 единиц массы NaCl и 85 единиц массы Н2О.
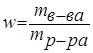 .
.
Мольная доля – отношение химического количества растворенного вещества (или растворителя) к сумме химических количеств всех веществ, составляющих раствор. В случае раствора одного вещества в другом мольная доля растворенного вещества (N2) равна
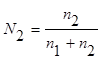 ,
,
а мольная доля растворителя (N1)
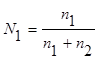 ,
,
где n1 и n2 – соответственно количество растворителя и растворенного вещества.
Молярная концентрация (молярность) – отношение химического количества растворенного вещества к объему раствора. Обычно молярность обозначается См или (после численного значения молярности) М. Так, 2 М Н2SO4 означает раствор, в каждом литре которого содержится два моля серной кислоты, то есть См = 2 моль/дм3.
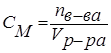 .
.
Моляльность (моляльная концентрация) – отношение химического количества растворенного вещества к массе растворителя. Обычно моляльность обозначается буквой m. Так, для раствора H2SO4 запись m=2 моль/кг (Н2О) означает, что в этом растворе на каждый килограмм растворителя (воды) приходится два моля Н2SO4. Моляльность раствора в отличие от молярности не изменяется при изменении температуры.
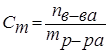 .
.
Нормальность (нормальная или эквивалентная концентрация) – отношение числа эквивалентов растворенного вещества к объему раствора. Концентрация, выраженная этим способом, обозначается Сn или (после численного значения нормальности) буквой н. Так, 2 н. Н2SO4 означает раствор, в каждом литре которого содержится 2 эквивалента Н2SO4, то есть 98 г Н2SO4.
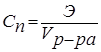 .
.
Эквивалент кислоты – это её количество, содержащее один эквивалент водорода, способного замещаться металлом.
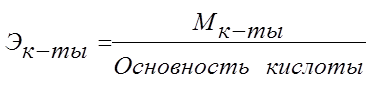
Эквивалент основания – это его количество, которые реагирует с эквивалентами кислот.
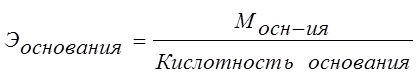
Эквивалент соли может быть вычислен как частное от деления ее молярной массы на произведение числа ионов металла и его валентности:
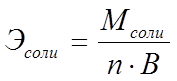
Пользуясь растворами, состав которых выражен нормальностью, легко рассчитать, в каких объемных отношениях они должны быть смешаны, чтобы растворенные вещества прореагировали без остатка. Пусть V1 раствора вещества 1 с нормальностью N1 реагирует с V2 раствора вещества 2 с нормальностью N2. Это означает, что в реакцию вступило N1V1 эквивалентов вещества 1 и N2V2 эквивалентов вещества 2. Но вещества реагируют в эквивалентных количествах, следовательно
N1V1 = N2V2 и
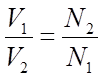
Т.е. объемы растворов реагирующих веществ обратно пропорциональны их нормальностям.
Первый закон Рауля
Над каждой жидкостью (растворителем или раствором) устанавливается определенное давление пара, насыщающего пространство. Это давление характеризует состояние равновесия между жидкой фазой и находящимися над нею молекулами растворителя.
Рассмотрим растворы нелетучих веществ, такие, над которыми давление пара обусловлено определенной концентрацией молекул растворителя, а концентрация молекул растворенного вещества практически равна нулю или имеет ничтожно малую величину, которой можно пренебречь. Давление пара над такими растворами меньше, чем давление пара над чистыми растворителями при той же температуре.