Статья: Химическая связь. Типы взаимодействия молекул
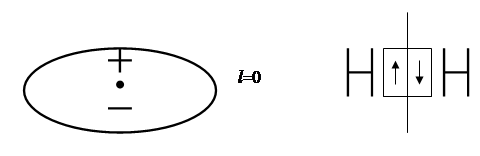
Между разными атомами чистая ковалентная связь может проявляться, если электроотрицаельность (ЭО)1 атомов одинакова. Т акие молекулы электросимметричны, т.е. «центры тяжести» положительных зарядов ядер и отрицательных зарядов электронов совпадают в одной точке, поэтому их называют неполярными.
Если соединяющиеся атомы обладают различной ЭО, то электронное облако, находящееся между ними, смещается из симметричного положения ближе к атому с большей ЭО:
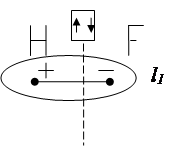
Смещение электронного облака называется поляризацией. В результате односторонней поляризации центры тяжести положительных и отрицательных зарядов в молекуле не совпадают в одной точке, между ними возникает некоторое расстояние (l). Такие молекулы называются полярными или диполями, а связь между атомами в них называется полярной.
Полярная связь – разновидность ковалентной связи, претерпевшей незначительную одностороннюю поляризацию. Расстояние между «центрами тяжести» положительных и отрицательных зарядов в молекуле называется длиной диполя. Естественно, что чем больше поляризация, тем больше длина диполя и больше полярность молекул. Для оценки полярности молекул обычно пользуются постоянным дипольным моментом (Мр), представляющим собой произведение величины элементарного электрического заряда (e) на длину диполя (l), т.е. ![]() .
.
Дипольные моменты измеряют в дебаях Д (Д = 10-18 эл. ст. ед. × см, т.к. элементарный заряд равен 4,810-10 эл. ст. ед., а длина диполя в среднем равна расстоянию между двумя ядрами атомов, т.е. 10-8 см) или кулонометрах (Кл×м) (1 Д = 3,33·10-30 Кл×м) (заряд электрона 1,6·10-19 Кл умноженный на расстояние между зарядами, например, 0,1 нм, тогда Мр = 1,6·10-19×1×10-10 = 1,6·10-29 Кл · м). Постоянные дипольные моменты молекул имеют значения от нуля до 10 Д.
У неполярных молекул l = 0 и Мр = 0, т.е. они не обладают дипольным моментом. У полярных молекул Мр > 0 и достигает значений 3,5 – 4,0 Д.
При очень большой разности ЭО у атомов имеет место явная односторонняя поляризация: электронное облако связи максимально смещается в сторону атома с наибольшей ЭО, атомы переходят в противоположно заряженные ионы и возникает ионная молекула:
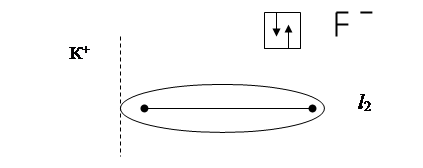
Ковалентная связь становится ионной. Электроасимметрия молекул возрастает, длина диполя увеличивается, дипольный момент возрастает до 10 Д.
Суммарный дипольный момент сложной молекулы можно считать равным векторной сумме дипольных моментов отдельных связей. Дипольный момент обычно принято считать направленным от положительного конца диполя к отрицательному.
Предсказать полярность связи можно с помощью относительной ЭО атомов. Чем больше разность относительных ЭО атомов, тем сильнее выражена полярность: DЭО = 0 – неполярная ковалентная связь; DЭО = 0 – 2 – полярная ковалентная связь; DЭО = 2 – ионная связь. Правильнее говорить о степени ионности связи, поскольку связи не бывают ионными на 100%. Даже в соединении CsF связь ионная только на 89%.
Химическая связь, возникающая за счет перехода электронов от атома к атому, называется ионной, а соответствующие молекулы химических соединений – ионными. Для ионных соединений в твердом состоянии характерна ионная кристаллическая решетка. В расплавленном и растворенном состоянии они проводят электрический ток, обладают высокой температурой плавления и кипения и значительным дипольным моментом.
Если рассматривать соединения элементов какого-либо периода с одним и тем же элементом, то по мере передвижения от начала к концу периода преимущественно ионный характер связи сменяется на ковалентный. Например, у фторидов 2-го периода LiF, BeF2, CF4, NF3, OF2, F2 степень ионности связи от фторида лития постепенно ослабевает и заменяется типично ковалентной связью в молекуле фтора.
Таким образом, природа химической связи едина: принципиального различия в механизме возникновения ковалентной полярной и ионной связей нет. Эти виды связи отличаются лишь степенью поляризации электронного облака молекулы. Возникающие молекулы отличаются длинами диполей и величинами постоянных дипольных моментов. В химии значение дипольного момента очень велико. Как правило, чем больше дипольный момент, тем выше реакционная способность молекул.
Механизмы образования химической связи
В методе валентных связей различают обменный и донорно-акцепторный механизмы образования химической связи.
Обменный механизм. К обменному механизму образования химической связи относятся случаи, когда в образовании электронной пары от каждого атома участвует по одному электрону.
В молекулах Н2, Li2, Na2 связи образуются за счет неспаренных s-электронов атомов. В молекулах F2 и Cl2 – за счет неспаренных р-электронов. В молекулах HF и HCl связи образуются s-электронами водорода и p-электронами галогенов.
Особенностью образования соединений по обменному механизму является насыщаемость, которая показывает, что атом образует не любое, а ограниченное количество связей. Их число, в частности, зависит от количества неспаренных валентных электронов.
Из квантовых ячеек N и Н можно видеть, что атом азота имеет 3
| N | ¯ | | | | H | |
| 2s | 2p | 1s |
неспаренных электрона, а атом водорода – один. Принцип насыщаемости указывает на то, что устойчивым соединением должен быть NH3, а не NH2, NH или NH4. Однако существуют молекулы, содержащие нечетное число электронов, например, NO, NO2, ClO2. Все они характеризуются повышенной реакционной способностью.
На отдельных стадиях химических реакций могут образовываться и валентно ненасыщенные группы, которые называются радикалами, например, H, NH2, O, CH3. Реакционная способность радикалов очень высока и поэтому время их существования, как правило, мало.
Донорно-акцепторный механизм
Известно, что валентно насыщенные соединения аммиак NH3 и трифторид бора BF3 реагируют друг с другом по реакции
NH3 + BF3 = NH3BF3 + 171,4 кДж/моль.
Рассмотрим механизм этой реакции:
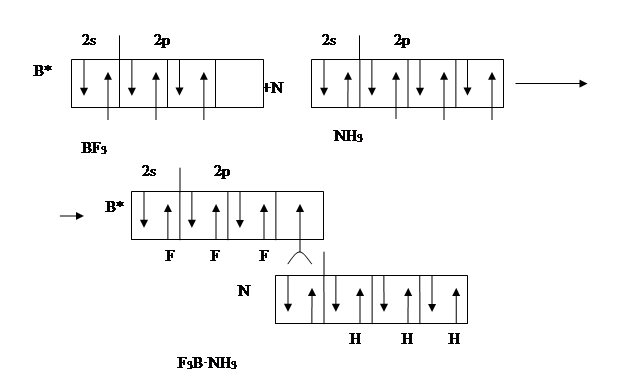 Видно, что из четырех орбиталей бора три заселены, а одна - остается вакантной. В молекуле аммиака заселены все четыре орбитали азота, из них три – по обменному механизму электронами азота и водорода, а одна содержит электронную пару, оба электрона которой принадлежат азоту. Такая электронная пара называется неподеленной электронной парой. Образование соединения H3N · BF3 происходит за счет того, что неподеленная электронная пара аммиака занимает вакантную орбиталь фторида бора. При этом уменьшается потенциальная энергия системы и выделяется эквивалентное количество энергии. Подобный механизм образования называют донорно-акцепторным, донором – такой атом, который отдает свою электронную пару для образования связи (в данном случае атом азота); а атом, который предоставляя вакантную орбиталь, принимает электронную пару, называется акцептором (в данном случае атом бора). Донорно-акцепторная связь является разновидностью ковалентной связи.
Видно, что из четырех орбиталей бора три заселены, а одна - остается вакантной. В молекуле аммиака заселены все четыре орбитали азота, из них три – по обменному механизму электронами азота и водорода, а одна содержит электронную пару, оба электрона которой принадлежат азоту. Такая электронная пара называется неподеленной электронной парой. Образование соединения H3N · BF3 происходит за счет того, что неподеленная электронная пара аммиака занимает вакантную орбиталь фторида бора. При этом уменьшается потенциальная энергия системы и выделяется эквивалентное количество энергии. Подобный механизм образования называют донорно-акцепторным, донором – такой атом, который отдает свою электронную пару для образования связи (в данном случае атом азота); а атом, который предоставляя вакантную орбиталь, принимает электронную пару, называется акцептором (в данном случае атом бора). Донорно-акцепторная связь является разновидностью ковалентной связи.
В соединении H3N · BF3 азот и бор – четырехвалентны. Атом азота повышает свою валентность от 3 до 4 в результате использования неподеленной электронной пары для образования дополнительной химической связи. Атом бора повышает валентность за счет наличия у него свободной орбитали на валентном электронном уровне. Таким образом, валентность элементов определяется не только числом неспаренных электронов, но и наличием неподеленных электронных пар и свободных орбиталей на валентном электронном уровне.
Более простым случаем образования химической связи по донорно-акцепторному механизму является реакция аммиака с ионом водорода: