Статья: Молекулярный механизм эволюции
Открытие, о котором я хочу рассказать, стало достоянием научной общественности, когда в журнале „Nature“ была опубликована статья под названием „HSP-90 как пособник морфологической эволюции“. Непосвящённым людям это название, конечно, не говорит ничего, но специалисты тотчас распознали под этой сугубо академической шапкой сенсационное содержание. Впрочем, точнее всего сформулировали сущность нового открытия сами его авторы — американские исследовательницы Сюзанна Резерфорд и Сюзэн Лундквист, которые открыли раздел „Обсуждение результатов“ знаменательной фразой: „Мы впервые, насколько нам известно, нашли свидетельства существования специального молекулярного механизма, который способствует процессу эволюционных изменений в ответ на изменения окружающих условий“. Ещё более просто то же самое было сказано в комментарии британской радиостанции „Би-би-си“: „Открыт молекулярный механизм эволюции!“ (Правда, справедливости ради следует отметить, что авторы сопроводили подзаголовок своей статьи — „Механизм эволюционности“ — не восклицательным, а куда более осторожным вопросительным знаком.)
Что же это значит — молекулярный механизм эволюции? Мы все знаем, что эволюция видов происходит в результате появления случайно изменившихся особей и естественного отбора из их числа тех, которые лучше приспособлены к меняющимся условиям окружающей среды. Но это, так сказать, „макроопределение“. Несомненно, процесс появления „изменившихся особей“ начинается с каких-то молекулярных изменений, ведь все признаки той или иной особи того или иного вида диктуются генами. Соответственно, и все изменения этих признаков должны начинаться на уровне генов, то есть на молекулярном уровне. Сегодня уже известно, что основной причиной таких изменений являются так называемые мутации. Мутация — это случайное изменение какого-то гена, вызванное радиационным, химическим или иным повреждением. Поскольку каждый ген управляет образованием того или иного клеточного белка или его части (а уже через эти белки — признаками организма в целом), то мутация в гене чаще всего ведёт в конечном счёте к некоторому искажению его белка — в случае так называемой микромутации, как правило, к „точечному“ искажению, попросту говоря — к замене одной определённой аминокислоты на другую. Последствия такой замены могут быть как очень вредными или даже смертельными для организма, если они затрагивают очень важное звено, либо же безвредными — нейтральными, а изредка (по счастливой случайности) даже полезными для лучшей адаптации к среде.
Всё сказанное не объясняет, однако, как же всё-таки происходит эволюция. Поясню на примере, в чём тут закавыка. Даже самый беглый взгляд на эволюцию биологических видов убеждает в том, что она ускоряется в условиях стресса, то есть ситуации, возникающей в результате резкого и неблагоприятного изменения внешних условий. Это хорошо известно, например, по отношению к бактериям. Попадая в ситуацию физиологического стресса, вызванную, например, голоданием или появлением в окружающей среде антибиотиков, они очень быстро отвечают на эту угрозу появлением множества новых мутантных разновидностей, среди которых обнаруживаются особи, успешно выживающие в новых условиях (становясь, например, резистентными к антибиотикам или приобретая способность усваивать прежде несъедобную пищу). Трудно представить себе, что именно в этих условиях мутации, которые и ведут в конечном счёте к появлению новых разновидностей бактерий, почему-то резко учащаются, ведь мутации — явления случайные, не приурочены же они именно к нужному моменту! Но ещё труднее представить, что бактерии каким-то чудом „целенаправленно отвечают“ на возникшую потребность приспособиться и выжить. Несомненно, должен существовать какой-то скрытый молекулярный механизм, который сам собою включается в условиях стресса, и — что увеличивает частоту мутаций? Каким образом? Загадка.
Между тем поведение бактерий — далеко не единственный пример „ускоренной“ эволюции в условиях стресса. Наука палеоантропология знает другой такой случай. Сегодня многие палеоантропологи считают, что аналогичным образом произошёл один из важнейших этапов в эволюции дальних предшественников человека — от так называемых австралопитеков к собственно гоминидам. Те из австралопитеков, которые от чисто растительного рациона перешли к мясной пище, должны были выходить из лесов в открытые африканские саванны, чтобы найти себе там такую пищу (остатки недоеденных хищниками животных), и в ходе таких поисков порой забредали в изолированные от окружающего мира долины или ущелья. Там, оказавшись в трудных условиях, угрожавших их выживанию, они, по мнению палеоантропологов, эволюционировали (адаптировались) быстрее, чем те группы австралопитеков, которые оставались в привычных условиях леса и не нуждались в такой адаптации. Чем дольше была изоляция, тем больше накапливалось в группе таких эволюционных изменений, пока она окончательно не превратилась в новую, более совершенную группу Гомо.
Знаменитый „Кембрийский взрыв“ свидетельствует, что подобные явления могут происходить и в более громадных масштабах. Напомним, что „Кембрийским взрывом“ называется в биологии краткий (около миллиона лет) период быстрого (в геологических масштабах времени, разумеется) появления огромного числа новых биологических видов, отличавшихся радикально изменёнными телесными формами и структурами, например, именно тогда впервые возникли позвоночные, к которым принадлежит и человек. Сегодня считается, что этот период, отстоящий от нас почти на 500 миллионов лет, начался с резкого быстрого нарастания концентрации кислорода в земной атмосфере, что создало стрессовые условия для существовавших тогда организмов. Между прочим, не менее знаменитая катастрофа — исчезновение динозавров, произошедшее около 65 миллионов лет назад, скорее всего, в результате столкновения Земли с огромным метеоритом, — тоже сопровождалось ускоренным появлением множества новых видов (например, нынешних млекопитающих), причём, как показал американский исследователь Д. Яблонский, именно в ближайших окрестностях места падения метеорита, в районе нынешнего Мексиканского залива, новые виды появились раньше всего, уже через миллион лет после катастрофы, а ведь именно там стресс должен был быть сильнее всего.
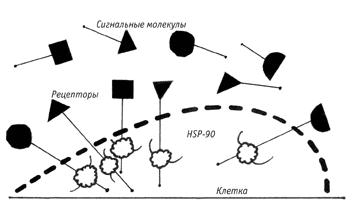
На поверхности клетки располагаются рецепторы различного вида, которые взаимодействуют со своими сигнальными молекулами
Все эти примеры показывают, что неблагоприятные, стрессовые изменения среды не просто способствуют эволюции, но резко ускоряют её, порой в громадных масштабах, но это лишь усугубляет загадку — каков же молекулярный механизм такого ускорения? Каким образом ухитряются наследственные молекулы ДНК так быстро меняться именно в нужный момент? Откуда берется — опять-таки именно в нужный момент — такое множество благоприятных мутаций сразу?
Открытие Сюзанны Резерфорд и Сюзэн Лундквист, с рассказа о котором мы начали эту заметку, как раз и наметило контуры возможного ответа на все эти вопросы. Эти исследовательницы выбрали в качестве объекта изучения некий специфический белок, функции которого в организме связаны, с одной стороны, со стрессом, а с другой — с развитием и изменением клеток. Эта его двойственная роль, по мнению исследовательниц, должна была позволить проследить связь между стрессом и клеточными (а в конечном счёте — и организменными) изменениями на самом глубоком, молекулярном уровне.
Белок этот называется HSP-90, что и обусловило название статьи в „Nature“. Он относится к широкой и важной группе так называемых белков теплового шока, назначение которых, как видно из их определения, состоит в защите клеточных белков от теплового воздействия, то есть от „шока“, который может быть вызван резким повышением температуры окружающей среды. Повышение температуры, вообще говоря, смертельно опасно для любых белков — оно разрушает химические связи внутри них, а это приводит к утрате молекулой белка его специфической формы, а с нею и способности к выполнению своих функций в клетке. Этот исход наглядно демонстрирует белок сваренного куриного яйца. Так вот, белки теплового шока, плавающие в межклеточной среде и окружающие снаружи поверхность клеток, как бы принимают тепловой удар на себя и благодаря этой своей „самоотверженности“ предотвращают (до определённого предела, разумеется) разрушение клеточных белков. Исследования последних лет показали, что те же белки теплового шока способны защищать клеточные белки и от многих других опасностей и стрессов, например кислородного голодания, химических повреждений и даже от атаки некоторых патогенов. Более того, проникая в клетку, они защищают её белки даже в отсутствие стресса, когда эти белковые молекулы только образуются внутри клетки, и до тех пор, пока они не свернутся надлежащим образом. Таким образом, белки теплового шока впору назвать просто „защитными“.

Защитный белок HSP-90 поддерживает молекулу сигнального рецептора в стабильном состоянии
Среди всех этих общезащитных белков HSP-90 выделяется одной уникальной особенностью. Он не занимается защитой образующихся белковых молекул. Подавляющее большинство его „подопечных“ белков относится к классу так называемых передатчиков сигнала (signal transducers). Типичным примером таких передатчиков являются рецепторы клетки. Рецепторы — это белки, назначение которых состоит в распознавании специфических молекул, плавающих в межклеточном пространстве, и соединении с теми из них, которые определённым образом „соответствуют“ данному рецептору. Белок-рецептор имеет удлинённую форму: его „головка“, как грибок, торчит над поверхностью клетки, „тельце“ пронизывает её клеточную мембрану, а „хвост“ находится внутри клетки.
Рецепторы — „передатчики сигналов“ рассчитаны на соединение с теми специфическими молекулами (гормонами, феромонами, нейротрансмиттерами, факторами роста и т. д.), которые циркулируют в межклеточной среде, перенося химические сигналы от одних клеток к другим. Известно, например, что в процессе роста эмбриона такие „сигнальные молекулы“ понуждают клетки в определённых местах эмбриона к специализации, командуя им превращаться в клетки глаза, конечностей, сердца и т. д. Как это происходит? Когда сигнальная молекула садится на торчащую из клетки „чашечку“ рецептора, это вызывает в рецепторе изменение его формы — как говорят, „конформационное изменение“. Такое изменение продвигается вдоль тела рецептора и достигает его „хвоста“, находящегося внутри клетки. Окружающие этот „хвост“ специальные белки, киназы, под воздействием такого конформационного изменения понуждаются вступать в специфические биохимические реакции, что влечёт за собой целый каскад последовательных химических превращений, достигающих в конечном счёте наследственных молекул, укрытых в ядре клетки.
Это и есть процесс передачи „сигнала“ из окружающей клетку среды к её наследственным молекулам. Упомянутый каскад внутриклеточных реакций, вызванный таким сигналом, может, например, привести к тому, что на какой-то ген наследственной молекулы сядет молекула белка, блокирующая или, наоборот, усиливающая его работу. А это уже, в свою очередь, влияет на темп роста клетки, характер метаболизма в ней, процесс её деления или даже её специализацию в ходе эмбрионального развития. Дело в том, что специализация клеток эмбриона (то есть превращение их в клетки глаза или сердца) напрямую зависит от того, какие гены в её наследственной молекуле включены, а какие заблокированы.
Вернёмся, однако, к защитному белку HSP-90. Где его место в нарисованной картине передачи сигналов? Оказывается, сигнальные рецепторы очень неустойчивы. Грубо говоря, та цепь звеньев-аминокислот, которая составляет их „хвост“, „тельце“ и наружную „чашечку“, имеет тенденцию менять свою форму под воздействием даже небольших изменений, например, в результате мельчайших изменений в составе этой цепи вроде случайной (в результате „точечной“ мутации) замены одной аминокислоты на другую. Понятно, что такое изменение формы „чашечки“ влияет на её способность узнавать нужную „сигнальную молекулу“ и соединяться с ней. В результате сигнал либо вообще не поступает в клетку, либо поступает „искажённым“ и вызывает иные последствия в наследственных молекулах. Развитие клетки (а порой и организма в целом) может пойти по „аномальному“ пути. Для того чтобы этого не произошло, природа и „придумала“ защитный белок HSP-90. Вторая его функция (кроме защиты от теплового шока) состоит как раз в том, чтобы удерживать рецепторы — передатчики сигналов в той конформации, которая необходима для нормального приёма и передачи сигнала. Упрощённо действие этого белка можно представить себе как чисто механическое (на самом деле, оно химическое) удерживание „чашечки“ рецептора в нужной форме до момента прихода сигнальной молекулы.
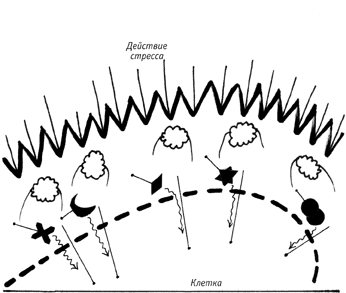
При мощном внешнем воздействии молекулы HSP-90 устремляются на борьбу с ним, а это позволяет проявиться скрытым мутациям.
Эта роль HSP-90 была первоначально обнаружена при изучении дрожжей. Было установлено, что при нормальной температуре искусственное (путём химического воздействия) понижение концентрации этого белка в организме дрожжей влечёт за собой полное прекращение передачи в клетки сигналов от тех рецепторов, которые обычно связаны с молекулами HSP-90. То же самое происходит, если вместо искусственного снижения концентрации HSH-90 просто повысить температуру окружающей среды. Оно и понятно: при повышении температуры часть молекул этого белка отвлекается на защиту клетки от теплового шока, а оставшихся молекул, видимо, недостаточно для стабилизации сигнальных рецепторов. Иными словами, при любом — чисто химическом или тепловом — уменьшении числа молекул HSP-90, обслуживающих сигнальные рецепторы, происходит то или иное нарушение нормальных сигнальных путей.
К чему же ведёт такое нарушение? Резерфорд и Лундквист решили выяснить это на примере плодовых мушек, знаменитых дрозофил. В нескольких лабораториях было обнаружено, что у дрозофил можно вызвать такую мутацию в одной из их наследственных молекул, что в результате образующийся в их организме белок HSP-90 окажется „испорченным“. Американские исследовательницы предположили, что это должно повлиять на сигнальные процессы в организмах дрозофил, как влияет на эти процессы снижение концентрации этого белка в организме дрожжей, и задались целью детально изучить последствия таких нарушений. Для этой цели они отобрали коллектив мушек-мутантов с испорченным HSP. Когда они стали скрещивать этих дефектных мушек с обычными, у которых HSP не был испорчен мутацией, то убедились, что заметное число потомков таких пар (дефектный — нормальный) тоже обладает аналогичными дефектами.
Что же могло изменить нормальное развитие мушек с „испорченным“ HSP-90? Существовали три возможности. Во-первых, такие мутанты могли оказаться просто более чувствительными к микроизменениям окружающей среды, что и вызвало появление дефектов их эмбрионального развития, — напомним, что этот белок, кроме своего действия на сигнальные рецепторы, защищает клетки и от всяких стрессов, вызванных такими микроизменениями.
Во-вторых, могло статься, что HSP-90 каким-то образом участвует в контроле за удвоением наследственных молекул при делении клеток, тогда при его отсутствии или порче это удвоение могло происходить не вполне точно, с генетическими ошибками.
Наконец, была и третья, самая интересная возможность: в аминокислотных цепях сигнальных рецепторов могли существовать какие-то скрытые мутации, какие-то заменённые аминокислоты, — напомним, что такие замены, как мы уже говорили, как раз и вызывают нежелательные изменения формы рецептора. Пока белок HSP-90 „насильственно“ удерживал рецептор в нужной (нормальной) форме, влияние этих скрытых мутаций не могло проявиться, но как только его стабилизирующее наружное действие было устранено (из-за его порчи), эти скрытые мутации дали о себе знать. Они изменили форму рецептора, это повлияло на передачу сигналов, а искажённые сигналы вызвали аномальное развитие клеток. Как уже было описано выше, клетки эмбриона, которые должны были получить сигнал на специализацию в клетки глаза, при искажении сигнала могли специализироваться в клетки конечностей и т. п.
Почему третья возможность — „самая интересная“? Потому что в этом случае вырисовывается вероятная картина молекулярного механизма ускоренной эволюции под стрессом: стресс отвлекает часть молекул HSP-90 от задачи стабилизации сигнальных рецепторов, это позволяет „проявиться“ сразу всем тем скрытым мутациям, которые накоплены в сигнальных рецепторах за предшествующие поколения, а проявление сразу большого числа ранее накопленных мутаций как раз и обеспечивает то ускоренное возникновение многочисленных разновидностей, которое никак нельзя было объяснить одновременным появлением всего этого множества мутаций как раз в процессе стресса.
Иными словами, загадка ускоренной эволюции под стрессом решалась бы именно тем, что эта быстрота обусловлена не одновременным появлением множества новых мутаций, а одновременным проявлением множества мутаций, накопленных ранее, но до поры до времени (стресса) скрытых.
Теперь мне остается лишь сказать, что последующие эксперименты Резерфорд и Лундквист подтвердили именно эту, третью возможность.
Попутно выявилось ещё одно интереснейшее обстоятельство. Оказалось, что если скрещивать дефектных мушек до шестого-седьмого поколения, то проявление некоторых дефектов (например, глаза и крыла) перестаёт зависеть от наличия или отсутствия HSP-90. Как это понимать?
Резерфорд и Лундквист объяснили это тем, что существует, видимо, какой-то порог проявления скрытых мутаций: если их число в молекуле рецептора ниже определённого, „порогового“ значения, они могут влиять на форму рецептора только при полном отсутствии HSP-90, но если их число выше этого порога, они проявляются (то есть влияют на рецептор и меняют сигнальные пути, что приводит к появлению дефектных эмбрионов) независимо от стабилизирующего действия защитного белка. Грубо говоря, способность скрытых мутаций влиять на аминокислотную цепь рецептора становится больше способности HSP-90 удерживать эту цепь от таких влияний. Иначе говоря, с увеличением числа поколений происходит накопление скрытых мутаций, ведущее в конце концов к их проявлению даже вопреки действию HSP-90.
Почему всё это так важно? Подставьте на место слова „дефект“ более широкое словосочетание „новый признак“ (ведь появление дефекта есть частный случай появления нового признака), и вся описанная выше картина тотчас окажется картиной эволюции в естественных условиях.
--> ЧИТАТЬ ПОЛНОСТЬЮ <--