Статья: Спектроскопическое определение несимметричного диметилгидразина в объектах окружающей среды
По данным кинетических кривых были построены зависимости времени реакций между НДМГ и ароматическими альдегидами от температуры их проведения, показанные на рис.6.
Как видно, максимальная скорость реакции деривации НДМГ альдегидами обеспечивается нагреванием при 80оС.

Рисунок 5 – Зависимость величины аналитического сигнала
от времени реакции с 5-фенилпентадиен-2,4-алем при 100 (1), 80 (2), 60 (3) и 20оС (4)
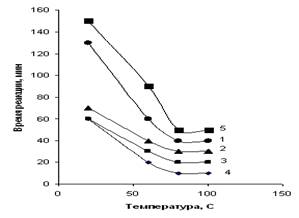
Рисунок 6 – Зависимость времени реакции от температуры
с о-нитробензальдегидом (1), м-нитробензальдегидом (2),
п-нитробензальдегидом (3), коричным альдегидом (4)
и 5-фенилпентадиен-2,4-алем (5)
Изучение кинетических параметров флуоресценции диметилгидразонов
Для объяснения закономерностей процессов излучения диметилгидразонов в зависимости от структуры и свойств применяемых реагентов на основе данных флуориметричекских измерений использовали кинетическую схему Штерна-Фольмера, описывающую фотофизический процесс флуоресценции и позволяющую рассчитать константу флуоресценции (к2), константу дезактивации (к3) и константу диссоциации флуоресцирующего вещества (к4).
В соответствии с данной схемой перечисленные константы являются членами уравнения (1):
Ia/Iфл= к3/к2*[АВ]+к4/к2+1, (1)
где Ia – интенсивность поглощенного излучения, Iфл – интенсивность флуоресценции, [АВ] – концентрация флуоресцирующего вещества.
Величина Ia при малой толщине поглощающего слоя является постоянной и не зависит от концентрации, то есть считается, что падающее излучение поглощается полностью. Графическая зависимость, построенная в координатах 1/Iфл – Cндмг, линейна в диапазоне концентраций НДМГ градуировочной кривой. Константа к2 соответствует тангенсу угла наклона прямолинейного участка кинетической кривой при температуре 20оС, соответствующей условиям измерения аналитического сигнала. Остальные константы рассчитываются из коэффициентов уравнения регрессии (1).
Значения энергии активации реакции конденсации НДМГ с ароматическими альдегидами определяли графически из уравнений, описывающих кривые, построенные по логарифмическому выражению уравнения Аррениуса:
ln1/τ= -Еа/RT+lnA, (2)
где τ – время реакции при данной температуре, Т – температура, R – универсальная газовая постоянная, Еа – энергия активации, А – предэкспотенциальный множитель.
Вид зависимостей ln1/τ= f(1/T) показан на рис. 7. Соответствующие значения рассчитанных энергий активации реакций НДМГ с альдегидами представлены в табл. 1.

Рисунок 7 – Зависимость ln1/τ от 1/Т с о-нитробензальдегидом (1),
коричным альдегидом (2), 5-фенилпентадиен-2,4-алем (3),
п-нитробензальдегидом (4) и м-нитробензальдегидом (5)
Таблица 1 – Значения констант фотофизических процессов
диметилгидразонов и энергий активации реакций
взаимодействия НДМГ с ароматическими
альдегидами
| Альдегид | к2 | к3 | к4 |
Еа, К-во Просмотров: 372
Бесплатно скачать Статья: Спектроскопическое определение несимметричного диметилгидразина в объектах окружающей среды
|