Статья: Строение и свойства координационных соединений меди(II) с некоторыми О, N – содержащими лигандами
3) ![]() ;
;
4) ![]() .
.
Таблица 2.
Параметры полос поглощения отдельных электронных переходов в комплексах меди(II) c соединениями I и II.
| № перехода | e, дм3∙моль-1∙см-1 | ν0, см-1 | δ½, см-1 | f, 10-4 |
| I | ||||
| 1 | 20 | 14047 | 1910 | 10.57 |
| 2 | 39 | 15422 | 1078 | 11.63 |
| 3 | 29 | 17111 | 1000 | 8.023 |
| 4 | 27 | 19033 | 1133 | 8.463 |
| II | ||||
| 1 | 12 | 14122 | 2100 | 6.972 |
| 2 | 39 | 15820 | 1284 | 13.85 |
| 3 | 23 | 17928 | 1036 | 6.592 |
| 4 | 18 | 19581 | 1022 | 5.089 |
Значения параметров МУП найдены нами решением полученных систем уравнений и приведены в таблице 3.
Анализ рассчитанных значений параметров МУП позволяет считать вариант (2) более предпочтительным, так как для него выполняется ряд соотношений: ![]() >
>![]() (где l=s, p), поскольку атом азота образует более прочные ковалентные связи;
(где l=s, p), поскольку атом азота образует более прочные ковалентные связи; ![]() ≈ 3-5 для всех донорных атомов и
≈ 3-5 для всех донорных атомов и ![]() , характерно для координационных связей меди(II) с N- и O-содержащими донорными группами.
, характерно для координационных связей меди(II) с N- и O-содержащими донорными группами.
Таблица 3.
Параметры МУП комплексных соединений, рассчитанные по электронным спектрам.
|
Вариант Параметры | Cu(II) + I | Cu(II) + II | ||||||
| (1) | (2) | (3) | (4) | (1) | (2) | (3) | (4) | |
| 7100 | 7100 | 7100 | 7100 | 7100 | 7100 | 7100 | 7100 | |
| 6947 | 8322 | 10011 | 11933 | 7022 | 8720 | 10828 | 12481 | |
| 1979.8 | 3011 | 3317 | 5719 | 1628 | 2901 | 3656 | 5722 | |
| 1018.8 | 2050 | 5122 | 6564 | 801 | 2074.5 | 5536 | 6776 | |
| 2824.3 | 4543 | 5810 | 7251 | 2681.5 | 4804 | 6385 | 7625 | |
Так как энергия ![]() -орбитали может быть меньше энергии
-орбитали может быть меньше энергии ![]() -орбитали лишь в случае отсутствия координации в аксиальных положениях, то можно считать, что данные электронной спектроскопии свидетельствуют о неучастии в координации атомов кислорода трифенилкарбинола в растворе и подтверждают предложенную выше структуру.
-орбитали лишь в случае отсутствия координации в аксиальных положениях, то можно считать, что данные электронной спектроскопии свидетельствуют о неучастии в координации атомов кислорода трифенилкарбинола в растворе и подтверждают предложенную выше структуру.
Таким образом, данные электронных спектров подтверждают структуру комплекса, предложенную выше.
Раздел 3.3 посвящен определению структуры комплекса меди(II) состава Cu(НGala)2×4H2O методом ИК спектроскопии.
Произведенный нами эмпирический анализ и сравнение ИК спектров галактаровой кислоты (ГК) и галактарата меди(II) показал, что при комплексобразовании происходит разрыв водородных связей свободной кислоты, и взаимодействие спиртовых групп (νОНспирт) ГК с ионом металла, причем только одна из карбоксильных групп ГК связывается с ионом меди(II), а другая – остается связанной водородной связью с карбоксильной группой ГК молекулы соседнего комплекса.
Расщепление полосы поглощения, принадлежащей валентным колебаниям карбонильной группы ГК, в спектре комплекса на две полосы поглощения 1618 и 1385 см-1, соответствующие антисимметричным и симметричным валентным колебанием депротонированной карбоксильной группы (νasCOO־ и νsCOO־, соответственно) ГК. Значение ΔνCOO־ равное 233 см-1 и присутствие в ИК спектре галактарата меди полосы средней интенсивности в области 1729 см-1 свидетельствует о монодентатной координации карбоксильной группы с ионом меди(II).
Понижение частот валентных колебаний связей С-О спиртовых групп (νС-Оспирт) в спектре комплекса на ~20 см-1 свидетельствует о взаимодействии спиртовых групп ГК с ионом меди(II), что приводит к изменению системы водородных связей.
На основании вышеизложенного нами предложена следующая структура соединения:
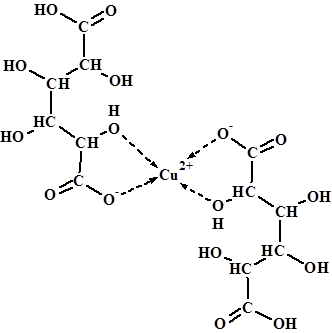 ,
,
исходя из которой, было проведено сравнение рассчитанных и экспериментальных данных (таблица 4).
Используемая нами методика пофрагментного расчета частот и форм нормальных колебаний сложных молекул предполагает предварительный расчет отдельных фрагментов участвующих в комплексообразовании, в частности лиганда, с уточнением исходных значений силовых постоянных в ходе расчета.
Таблица 4.
Экспериментальные и рассчитанные значения частот полос поглощения H2Gala и Cu(HGala)2∙4H2O (см-1).
| H2Gala | Cu(HGala)2∙4H2O |
Отнесение | ||
| Эксперимент | Расчет | Эксперимент | Расчет | |
| 3422пл, 3280ш | 3570, 3455 | 3577, 3477пл, 3304, 3160пл | 3570, 3400 | νOHспирт |
| 2968, 2921, 2870 | 2962, 2855 | 2969, 2923, 2857 | 2962, 2855 | νCH |
| 2656, 2560 | 3577, 3477 | 2656, 2559пл | - | νOHкарб |
| 1729 | 1729 | 1729 | - | νC=O |
| - | - | 1619 | 1619 | νasCOO¯ |
| 1455 | 1460 | 1452 | 1459 | δCCH |
| 1422 | 1412 | 1422пл | 1424 | δCОНспирт + δCОНкарб |
| 1375 | 1376 | 1365пл | 1376 | δCCH |
| - | - | 1385 | 1375 | νsCOO¯ |
| 1310пл, 1296, 1261пл | 1310, 1300, 1257 | 1310, 1298, 1262 | 1309, 1298, 1255 | δCCH + δCОНспирт |
| 1240, 1212, | 1240, 1211 | 1241, 1211 | 1240, 1211 | νC-С, |
| 1123, 1062 | 1117, 1052пл, 1047 | νC-Oспирт | ||
| 966 | 988 | τCСОНкарб | ||
| 919 | 920 | - | τCООН | |
| 862, 830, 801, 720пл, 700, 668, 633, 510, 465, 376, 283, 249, 242пл, 208, 179 пл, 139, 116, 74 | 879, 845, 802, 720пл, 698, 667, 634, 509, 467, 401, 373пл, 281, 236ш, 208, 179, 140, 119пл, 76 | Скелетные колебания (δCCС + τОССС + τОССО + τСССС + δОСО и т.п.) | ||
| - | - | 554, 442 | 607, 410 | νCu-O |
| - | - | 330, 152, 125, | 334, 155, 128 | δ(Cu-лиганд) |
Хорошее соответствие результатов расчета экспериментальным данным подтверждает предложенную нами выше структуру координационного окружения иона металла.
Выводы
Разработана методика определения строения и свойств комплексных соединений меди(II) путем совместного применении методов потенциометрического титрования и обработки электронных спектров, показана возможность ее использования для сложных систем, содержащих как бинарные, так и разнолигандные комплексные соединения.
При исследовании систем медь(II) – N-фосфонометилглицин – валин методами потенциометрического титрования и электронной спектроскопии определены значения констант устойчивости разнолигандных комплексов: Cu(PMG)Val2– и Cu(HPMG)Val–. Обнаружено, что образованию соединений Cu(H2PMG)(HVal)+ и Cu(HPMG)(HVal) препятствует большая устойчивость при низких рН бискомплексов с HPMG2- и H2PMG-, способными образовывать хелатные комплексы, в отличие от нейтральной формы валина. Большая устойчивость комплекса Cu(PMG)Val2– по отношению к Cu(PMG)24– может быть объяснена вхождением в координационную сферу иона металла хелатообразующего валинат-иона, занимающего два места в экваториальной плоскости комплекса.Тройной комплекс устойчив за счет тридентатного характера связывания глифосат-аниона.
По данным электронных спектров в комплексе CuPMG24- одна из донорных групп не принимает участие в связывании, а один из лигандов координирован бидентатно. В системе медь(II) - N-фосфонометилглицин - аминокислота возможно образование разнолигандных комплексов, имеющих высокую устойчивость, что необходим учитывать при моделировании процессов, протекающих в биологических системах с участием иона металла и глифосата.
Установлено, что в комплексообразовании меди(II) с 2-[2-гидроксифенил]-4,4-дифенил-1,2-дигидро-4Н-3,1-бензоксазином и 2-[2-гидрокси-5-нитрофенил]-4,4-дифенил-1,2-дигидро-4Н-3,1-бензоксазином участвуют азометиновые формы лигандов, при этом образуются соединения CuL2 с координацией по фенольной и азометиновой группам обоих лигандов. Методом разложения электронных спектров на Гауссовы составляющие определены энергии d-d переходов, проведен расчет параметров взаимодействия в рамках модели углового перекрывания и установлен порядок расположения орбиталей центрального атома по энергиям: ![]() .
.
На основании эмпирического отнесения полос поглощения в ИК спектре соединения Cu(HGala)2·4H2O определено строение координационного узла. Пофрагментным расчетом частот и форм нормальных колебаний для галактаровой кислоты и комплексного соединения с медью(II) подтверждено участие α-гидроксильной и карбоксильной групп галактаровой кислоты в координации иона меди(II), определены силовые постоянные связей металл-лиганд. Показано, что расчет колебательного спектра исследуемых соединений для фрагмента молекулы может заменить расчет полной структуры молекулы.