Статья: Световая депривация не влияет на характер протекания регенерации глаза гигантской африканской улитки Achatina fulica
Слияние отдельных ЭРГ на последовательные вспышки света происходит при межстимульном интервале в 1 – 2 секунды у нативных глаз моллюсков обеих групп и регенерировавших глаз моллюсков, содержавшихся на свету (рис. 2а, б). Ответы регенерировавших глаз светодепривированных животных сливаются при интервале около 5 секунд (рис. 2в, г).
|
|
|
|
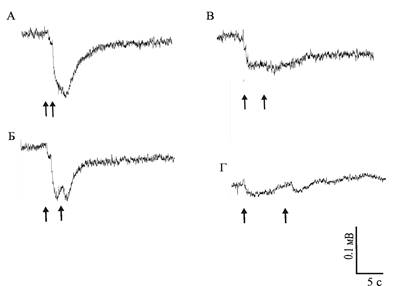
Рис. 2. ЭРГ нативного (а, б) и регенерировавшего (в, г) глаз светодепривированных моллюсков A. fulica. Стрелками обозначены моменты нанесения световой стимуляции. Интервал между стимулами:
а – 1 с, б – 2 с, в – 5 с, г – 10 с
Обсуждение
Световая депривация влияет на некоторые проявления жизнедеятельности Achatina fulica. В частности, содержание этих моллюсков при отсутствии света негативно сказывается на их репродуктивных способностях [11]. Уменьшаются также двигательная активность животных и количество потребляемой ими пищи. С другой стороны, постоянная темнота, так же как и удаление оптических щупалец, не приводит к изменению циркадианного ритма A. fulica [15].
Ограничение светового потока на сетчатку глаза нарушает формирование зрения в онтогенезе за счет недоразвития центрального отдела сенсорной системы как у позвоночных [6], так и у беспозвоночных [7] животных. Показано также, что длительная монохроматическая депривация приводит к нарушениям структуры соответствующих колбочек сетчатки рыбы [16]. Основываясь на сходстве процесса регенерации с формированием органов в онтогенезе, можно было бы предположить, что световая депривация влияет хотя бы на скорость восстановления глаза A. fulica. Однако наши исследования показали, что световая депривация не влияет на восстановление структуры и электрических свойств глаз брюхоногих моллюсков. Скорость регенерации глаз была одинакова у животных обеих экспериментальных групп: через месяц после удаления дистальной части оптического щупальца восстановление структур глаза наблюдалось в 100 % случаев. Восстановление линейных размеров глаза происходит также через месяц после операции. Наши данные, полученные на молодых особях A. fulica, подтверждают предварительные выводы [10], полученные на Strombus luhuanus. Таким образом, световая стимуляция не является необходимым фактором для протекания регенерационных процессов в периферическом отделе зрительной системы у брюхоногих моллюсков. Более того, электрические ответы регенерировавших глаз животных, содержавшихся в темноте, не отличаются от ответов регенерировавших глаз животных, содержавшихся при постоянном освещении. Остается, однако, вероятность того, что световые условия содержания регенерирующих улиток могут влиять на восстановление связей формирующегося глаза с нейронами церебральных ганглиев, что, безусловно, требует специального исследования.
Список литературы
1. Лакин Г.Ф. Биометрия: Учеб. пособие для биологов спец. вузов. М., 1990.
2. Меркулов Г.А. Гистологическая техника. М., 1961.
3. Одум Ю. Экология. М., 1986.
4. Ромейс Б. Микроскопическая техника. М., 1954.
5. Сидельников А.П. Регенерация глазного щупальца у гигантской африканской улитки Achatina fulica // Изв. РАН. Сер. биол. 1991. №5. С. 716 – 725.
6. Хьюбел Д. Глаз, мозг, зрение. М., 1990.
7. Barth M., Hirsch H.V., Meinertzhagen I.A., Heisenberg M.
Experience-dependent developmental plasticity in the optic lobe of Drosophila melanogaster // J. Neurosci. 1997. Vol. 17(4). Р. 1493 – 1504
8. Chase R., Kamil R. Morphology and odor sensitivity of regenerated snail tentacles // J. Neurobiol. 1983. Vol. 14. №1. Р. 43 – 50.
9. Eakin R.M., Ferlatte M.M. Studies of eye regeneration in a snail, Helix aspersa // J. Exp. Zool. 1973. Vol. 184. №1. P. 81 – 95.
10. Gillary H. Electrical potentials from the regenerating eye of Strombus // J. Exp. Biol. 1983. Vol. 107. P. 293 – 310.
11. Hodasi J.K.M. The effects of different light regimes on the behaviour and biology of Achatina (Linne) // J. Moll. stud. 1982. Vol. 48. Р. 283 – 293.
12. Leitner D., Francis A., Gazzaniga M. Optic nerve regeneration in goldfish under light deprivation // Brain Research Bulletin. 1982. Vol. 8. Р. 105 – 107.
13. Ramachandran A.V., Ndukuba P.I. Preliminary evidence for pineal-mediated extraretinal photoreception in relation to tail regeneration in the Gekkonid lizard, Hemidactylus flaviviridis // J. Pineal. Res. 1989. Vol. 6(2). P. 121 – 134.
14. Suzuki H., Watanabe M., Tsukahara Y., Tasaki K. Duplex system in the simple retina of a gastropode mollusc, Limax flavus L. // J. Comp. Physiol. 1979. Vol. 133. P. 125 – 130.
15. Takeda N., Ozaki T. Induction of locomotor behavior in the giant african snail, Achatina fulica // Comp. Biochem. Physiol. 1986. Vol. 83A. №1. P. 77 – 82.
16. Wagner H.J., Kroger R.H.H. Effects of long-term spectral deprivation on the morphological organisation of the outer retina of the blue acara (Aequidens pulcher) // Phil. Trans. R. Soc. Lond. 2000. Vol. 355. P. 1249 – 1252.