Дипломная работа: Аналіз можливих схем електрохімічних генераторів для автономних джерел електричної енергії
Характеристики основних накопичувачів енергії
|
№ з/п | Типи накопичувачів | ККД, % | Виділяєма енергія, кВт ч/м3 | Виділяєма потужність, Вт/кг | Виділяєма енергоємність, кДж/кг | Довговічність при глибині розряду |
| 1 | Інерційні | 90 | 60-150 | >104 | 10-60000 | >105 |
| 2 | Свинцево-кислотні | 75 | 30-60 | 500 | 64 | 300-500 |
| Нікель-кадмієві | 75 | 70-100 | 200 | 110 | 1000-3000 | |
| Окиснювально-відновлювальні | 75 | 15-60 | - | - | - | |
| Літієві | 75-80 | 40-1000 | - | - | 10 років | |
| 3 | ГАЕС | 75 | 300-500 | >104 | 28 | - |
| 4 | Молекулярні накопичувачі енергії | 95 | 0.2 | 104 | 1-10 | 104 -106 |
| 5 | Накопичувачі тепла | 30 | 600 | - | - | - |
| 6 | Термоелектричні генератори | 10 | 30 | 50 | - | - |
| 7 | ЕХГ | 10 | 500-1000 | 500-1000 | 70-104 | 5000 |
2. БУДОВА І СКЛАД ЕЛЕКТРОХІМІЧНОГО ГЕНЕРАТОРА
Серед важливіших проблем енергетики особливе місце займають проблеми безпосереднього перетворення хімічної енергії палива в електричну енергію. ЕХГ суттєво відрізняються від інших перетворювачів енергії, тому що енергія хімічної реакції безпосередньо перетворюється в електричну енергію, минаючи проміжну стадію перетворення її в теплоту. Тому ККД сучасних ЕХГ досягає 70-80%. Основною складовою частиною ЕХГ є паливний елемент. Для одержання необхідних значень напруги і струму паливні елементи об’єднуються у батареї.
На цей час достатньо розроблені і знаходять застосування в основному водень кисневі паливні елементи з пористими електродами (лужний електроліт) або з іонообмінними (кислий електроліт).
Паливні елементи першого типу (рис.2.1) мають два електрода, простір між якими заповнений електролітом. До одного електрода (анода) подається газоподібний водень, а до другого (катода) – кисень. Позитивні іони водню переходять у розчин і анод заряджається негативним зарядом. Внаслідок дії електростатичного притягання між негативно зарядженим анодом і позитивно зарядженими іонами водню на поверхні розділу електрод-розчин виникає подвійний електричний шар, позитивна сторона якого знаходиться у розчині, а негативна – у металі. Різниця потенціалів між сторонами називається електродним потенціалом. Навколо катода також виникає подвійний електричний шар, тому що негативно зарядженні іони кисню утримуються позитивно зарядженим катодом. При підключенні споживача збиток електронів з анода починає переходити до катоду, здійснюючи корисну роботу в зовнішньому ланцюгу. Коли щезнуть збиточні електрони, іони водню почнуть переходити у глиб розчину.
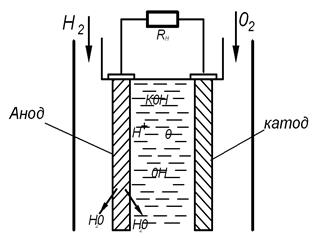
Рис. Схема паливного елемента
Порушення рівноваги між атомами і іонами палива приведе до виникнення нових іонів і електронів. Безперервний процес іонізації окислювача забезпечується переходом електронів до катоду.
Таким чином, в паливних елементах реакція йде не між атомами і молекулами, а між іонами. Етапи реакції:
1. Під впливом каталітичних властивостей анода молекули водню розпадаються на атоми і іонізуються з утворенням іонів і електронів
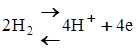 .
.
2. Електрони через споживач енергії переходять на катод, де створюються негативні іони кисню
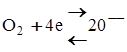 .
.
3. Іони кисню переходять у розчин електроліту і створюють іони гідроксилу
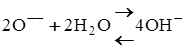 .
.
4. Іони гідроксилу переміщуються у розчині електроліту від катода до анода і створюється кінцевий продукт реакції – вода
 .
.
Для того, щоб не знижалася концентрація електроліту, необхідно постійно відводити воду.
Схема паливного елемента з іонообмінною мембраною приведена на рис.2.2. В такому елементі газові простори поділені мембраною, яка пропускає іони водню, але не пропускає молекули кисню і гідроксильні групи „ОН”.
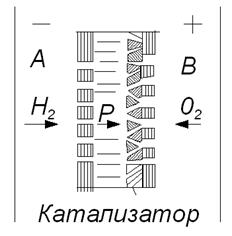
Рис. Схема паливного елемента з іонообмінною мембраною
Між поверхнею мембрани і пористими токозйомниками нанесений шар каталізатора, тобто іонообмінна мембрана виконує роль твердого електроліту. При „кислотній” мембрані вода створюється на стороні окислювача і виводиться спеціальними пристроями.
Таким чином, процес генерування енергії в паливних елементах описується, як процес обміну електронами між паливом і окислювачем з утворенням нового хімічного сполучення.
3 АНАЛІЗ РОБОЧОГО ПРОЦЕСУ ПАЛИВНИХ ЕЛЕМЕНТІВ
Відповідно з першим законом термодинаміки, щодо хімічних реакцій, змінювання повної внутрішньої енергії системи DUn дорівнюється теплоті хімічної реакції Q і здійсненої при цьому роботі LS
DUn =Q+LS . (3.1)
Під повною внутрішньою енергією розуміють суму фізичної Uф і хімічної Qx її частин