Дипломная работа: Изучение токсического влияния кадмия на активность аминотрансфераз у потомства белых крыс
Проведенные А.Е. Браунштейном и Э.Снеллом модельные эксперименты показали, что избирательный разрыв только одной из этих связей с образованием карбаниона, определяется особенностями строения активного центра фермента. Эти представления получили подтверждения при исследовании очищенных фосфопиридоксалевых ферментов. В 1966 году Донатан выдвинул и теоретически обосновал важное положение о том, что в альдимине, фиксированном в активном центре фермента, должна разрываться та из связей у α – углеродного атома, которая ориентирована перпендикулярно к плоскости пиридинового кольца пиридоксальфосфата. При такой ориентации энергия, необходимая для разрыва связи, минимальная вследствие перекрывания электронной орбитали связи с сопряженной π – системой кофермента ( σ – π - перекрывание). Донатан предположил, что конформация может контролироваться апоферментом, возможно с помощью связывания карбоксилат – иона, а также, что имин может принимать одну из трех возможных конформаций/29/.

Здесь прямоугольником обозначена плоскость пиридинового кольца, вертикальной линией изображена σ – связь. Конформамация (1) благоприятствует переаминированию.
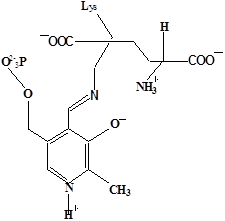
Методами спектрального анализа было установлено, что альдегидная группа связанного в активном центре пиридоксальфосфата образует так называемое “внутреннее” основание Шиффа с ε- NH2 – группой остатка лизина в белке. Из этого следует, что на начальном этапе каталитической реакции α – аминогруппа субстрата вытесняет ε- NH2 – группу лизина из связи с коферментом (стадия трансальдиминирования). На основании изучения спектральных, химических и кинетических свойств аспартат – трансаминазы был сделан вывод о том, что как прямая, так и обратная реакция переаминирования состоят из восьми стадий; интермедиаты, возникающие на этих стадиях, представлены на рисунке 2/27,28/.
На первом стадии происходит присоединение к ферменту субстратной аминокислоты с образованием нековалентного комплекса Михаэлиса. Далее один из протоков аминогруппы субстрата переходит на атом азота внутренней иминной связи (стадия 2); в результате аминогруппа приобретает нуклеофильные свойства, необходимые для атаки на атом С-4' кофермента. Эта атака приводит к образованию промежуточного тетраэдрического соединения (геминального диамина, стадия 3); за этим следует освобождение ε- NH2 – группы остатка лизина из связи с пиридоксальфосфатом и возникновение "внешнего" или субстратного альдимина (стадия 5), одной из форм которого является хинолоид показанный на рис.2. Последующее протонирование атома С-4' дает кетимин (стадия 6), при гидролизе которого образуется ПМФ – форма фермента и оксокислота (стадии 7 и 8). Далее реакция идет в обратном направлении между ПМФ – формой трансаминазы и другой ококислотой и приводит к регенерации ПЛФ – формы ("внутреннего" альдимина) и образованию новой аминокислоты.
Таким образом, реакции переаминирования являются обратимыми и универсальными для всех живых организмов. Пиридоксальфосфат в этих реакциях выполняет роль переносчика аминогруппы и в конечной стадии освобождается и может вновь вступить в ферментативный процесс.
Рисунок 2 - Основные интермедиаты, образующиеся в ходе реакции переаминирования.
а – внутренний альдимин;
б – нековалентный комплекс Михаэлиса;
в – то же, что σ, но атом иминного азота протонирован;
г– геминальный диамин;
д– внешний альдимии;
е - хинолоид;
ж – кетимин;
з – карбиноламин;
и- пиридоксаминфосфат.

![]()
![]()

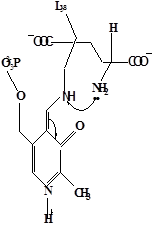
![]()
![]()
![]()

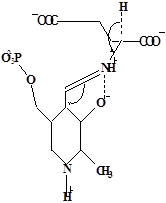

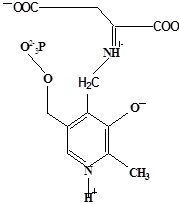
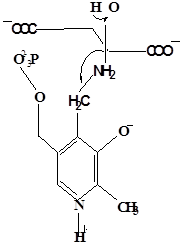

1.2.4 Биологическая роль трансаминаз
Аминокислоты, не использованные для синтеза белков и других производных, не накапливаются в организме в больших количествах. Они подвергаются различным ферментативным превращениям и, в конечном счете, распаду /32/. Важную роль в азотистом обмене играют процессы перехода одних аминокислот на другие, в результате ферментативных реакций переаминирования. При этом происходит обратимый перенос NH2 – группы от L – аминокислоты на L – кетокислоту без промежуточного образования аммиака. Таким образом, в реакции переаминирования участвуют L – аминокислота как донор и L – кетокислота как акцептор аминогруппы. Эти реакции катализируются особыми ферментами трансаминазами. Коферментом трансаминаз является пиридоксаль – 5׳ – фосфат, который и является промежуточным переносчиком аминогруппы от аминокислоты на кетокислоту/27/.
Широкое распространение трансаминаз в животных тканях, у микроорганизмов и растений, их высокая резистентность к физическим, химическим и биологическим факторам, абсолютная стереохимическая специфичность по отношению к L - и Д – аминокислотам, высокая каталитическая активность в процессах переаминирования послужили предметом детального исследования роли этих ферментов в обмене аминокислот/33/. Тип катализируемой химической реакции в сочетании с названием субстрата служит основой для систематического наименования ферментов. Согласно Международной классификации трансаминазы относят к 2 классу трансфераз, 4 подклассу – аминотрансферазы; наименование их составляется по форме «донор – транспортируемая группа – трансфераза» /34/. А. Е. Браунштейн выдвинул гипотезу о возможности существования в живых тканях не прямого пути дезаминирования аминокислот через реакции переаминирования, названного им трансдезаминированием. Основой для этой гипотезы послужили данные о том, что из всех природных аминокислот в животных тканях с высокой скоростью дезаминируются только L – глутаминовая кислота. Согласно этой теории большинство природных аминокислот сначала реагируют с L – кетоглутаровой кислотой в реакции переаминирования с образованием глутаминовой кислоты к соответствующей кетокислоте/30/. Образовавшаяся глутаминовая кислота подвергается окислительному дезаминированию под действием глутаматдегидрогеназы. Механизм трансдезаминирования можно представить в виде следующей схемы /13/:
![]()
![]()
![]()
![]() R1- CH (NH2)-COOHL-кетоглутарат НАДН2 + NH3
R1- CH (NH2)-COOHL-кетоглутарат НАДН2 + NH3
![]()
![]() R1- CO- COOHL-глутамат НАД + Н2О
R1- CO- COOHL-глутамат НАД + Н2О
трансаминаза глутаматдегидрогеназа
Обе реакции (переаминирование и дезаминирование глутаминовой кислоты) являются обратимыми, создаются условия для синтеза любой аминокислоты, если в организме имеются соответствующие L – кетокисл