Дипломная работа: Кристалохімія атомних дефектів у напівпровідниках структури сфалер
Рис 2. Графічне розміщення тетраедричних порожнин (ТП) для структур: а – сфалериту, б – в’юрциту
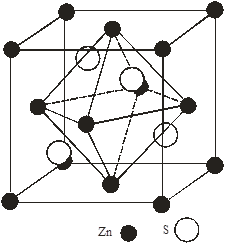
а) б)
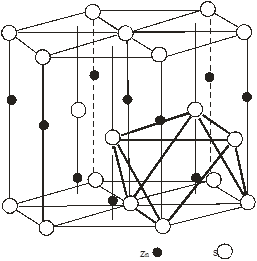
Рис 3. Графічне розміщення октаедричних порожнин (ОП) для структур: а – сфалериту, б – в’юрциту
2. Області існування структур сфалериту і в’ юрциту
Cтруктура в’юрциту для ZnS – стійка при високих температурах. Фазовий перехід із гексагональної модифікації ZnSв кубічну проходить при температурах 1020 і 1150 0 С [2]. В [4] показані поліморфні пари, зв’язані переходом під тиском, які зачіпають зміну першої координації для ZnOтиск переходу 100 кбар: низькотемпературна форма – в’юрцит, перша координація 4:4; високотемпературна форма – NaCl, перша координація 6:6. Для СdSтиск переходу 20 кбар: низькотемпературна форма – сфалерит,перша координація 4:4; високотемпературна форма – NaCl, перша координація 6:6. Зміна другої координації для CdSпроходить при тиску 160-200 кбар, при низькому тиску структурний тип сфалерит; привисокому тиску в’юрцит. Для CdSструктурна зміна при збільшені тиску обернена тій, яка викликається пониженням температури.Перехід із тетраедричної до октаедричної координації супроводжується зменшенням об’єму приблизно на 20 %. Незалежно від того чи має вихідний матеріал структуру в’юрциту чи цинкової обманки, при зворотньому переході до атмосферного тиску зберігається структура цинкової обманки [2].
Можливість зв’язати тип стабільної структури А2 В6 з співвідношенням іонності і ковалентності хімічного зв’язку розроблено авторами [5] (табл. 3).
Таблиця 3
Зв’язок стабільні структури А2 В6 з коефіцієнтом іонності
| А2 В6 | l,% | Стабільна структура | D(с/а) | А2 В6 | l,% | Стабільна структура | D(с/а) |
| ZnO | 82 | W | -293 | ZnSe | 33 | S | +65 |
| CdS | 45 | W | -103 | CdTe | 21 | S | +68 |
| CdSe | 40 | W | -24 | ZnTe | 16 | S | +81 |
| ZnS | 40 | S | +33 |
Як відомо, різниця в енергіях двох поліморфних модифікацій – в’юрцита і сфалерита, яка б мала вона не була, буде обумовлена різним вкладом іонності, про що свідчить порівняння їх констант Маделунга. Вони є мірою електростатичної взаємодії між іонами решітки, для структурного типу в’юрциту і сфалериту і рівні 1,641;1,638, яка є більшою для решітки в’юрциту [6]. Звідси можна зробити два висновки. По-перше, якщо сполуки А2 В6 можуть кристалізуватися в двох модифікаціях, одна з яких метастабільна, то тоді характер зв’язку в гексагональній модифікації повинен бути більш іонним, чим у кубічній. Більший іонний характер структури в’юрциту експериментально доказаний вимірюванням ширини забороненої зони, яка для деяких сполук А2 В6 виявилася дещо більшою, ніж ширина забороненої зони тих же сполук, які мають структуру сфалериту [7-9]. По-друге, в ряді сполук А2 В6 з збільшенням долі іонності зв’язку (l) повинен спостерігатися перехід від стабільної структури сфалериту S до стабільної структури в’юрциту W (табл. 3).
3. Радіуси тетраедричних і октаедричних порожнин для сфалериту і в’юрциту
Коли необхідно підкреслити зв’язок атомів в сполуках використовують для одного і того ж атома різні радіуси: ковалентні, іонні, тетраедричн і октаедричні ковалентні радіуси атомів в сполуках. Для атомів халькогенідного ряду цинку і кадмію вони приведені в таблиці 4.
Таблиця 4
Радіуси елементів в халькогенідах цинку і кадмію
| Елементи, r, Å | Zn | Cd | S | Se | Te | Література |
| Атомний, ra | 1,53 | 1,71 | 1,09 | 1,22 | 1,42 | |
| Ковалентний, rk | 1,25 | 1,48 | 1,02 | 1,16 | 1,36 | |
| Іонний, ri | 0,83 | 0,99 | 1,82 | 1,93 | 2,11 | |
| Тетраедричний, rt | 1,31 | 1,48 | 1,04 | 1,14 | 1,32 | [2] |
| Октаедричний, ro | 1,20 | 1,38 | 1,35 | 1,45 | 1,64 | [10] |
Повернемося до відомої теорії структур щільної упоковки, яка дозволяє в рамках цього підходу визначити всі необхідні геометричні характеристики кристалічних структур напівпровідників А2 В6 . В цій теорії під кристалічною будовою розуміють послідовну шарову упаковку твердих сфер з утворенням тетра- і октапорожнин [12].
Якщо вважати структури сфалериту і в’юрциту щільноупаковані по аніону тоді необхідне виконання наступних двох умов:
1) топологія аніонної підрешітки співпадає з топологією кількості щільноупакованих сфер, причому катіони розміщуються тільки в тетраєдричних і октаедричних міжвузлях цієї підрешітки;
2) потенціали міжатомної взаємодії Uмх , Uхх iUмм , відповідають нерівності (1)
Uмх >Uхх >Uмм , (1)
де М – метал, Х – неметал
Із простих геометричних уявлень можна одержати сукупність величин, які характеризують тетраедр, октаедр і елементарну комірку г.ц.к. решітки. Ці величини, однозначно зв’язані з радіусом сфер будови, тобто радіусами атомів кристалічної решітки, а відповідно і з параметром решітки (а,с) для сфалериту і в’юрциту показані в таблиці 5.
Таблиця 5
Зв’язок величин, які характеризують тетраедр і октаедр в г.ц.к. решітці з радіусом атома і періодом решітки для сфалериту і в’юрциту
| Параметр | Позначення | f (R) |
| Сфалерит | ||
| 1. Радіус атома | R | |
| 2. Період кристалічної решітки | a | a = 2RÖ2 |
| 3. Ребро тетраедра | a1 | a1 = 2R = 0,71a |
| 4. Висота тетраедра | h | h = 2RÖ2/3 = 0,578a |
| 5. Відстань від центра тетраедра до його основи | z | z = R/Ö6 = 0,41R= 0,145 a |
| 6. Відстань центра тетраедра від вершини | yt | yt =h-z = (3/Ö6)R = 0,433 a |
| 7. Відстань центра октаедра від вершини | yo | yo = RÖ2 |
| 8. Мінімальний радіус сфери, вписаної в тетрапорожнину | rt min | rt min = yt -R = 0,225 R |
| 9. Мінімальний радіус сфери, вписаної в октапорожнину | ro min | ro min = yo - R = 0,414 R |
| 10. Максимальний радіус сфери, вписаної в тетрапорожнину | rt max | rt max = 0,5 R |
| 11. максимальний радіус сфер, вписаних в октапорожнину | ro max | ro max = 0,732 R |
| В’юрцит | ||
| 1. Період кристалічної решітки | a, c |
a =1/2 √2 а(куб.) c = 2/3 √3 а(куб.) |
| 2. Ребро тетраедра | a1 | a1 = [1/3a2 + 1/4c2 ]1/2 |
| 3. Висота тетраедра | h | h = c/2 |
| 4. Відстань центра тетраедра від вершини | yt | yt = 2/3 h = c/3 |
| 5. Відстань центра октаедра від вершини | yo | yo = [1/4a2 + 3/16c2 ]1/2 |
| 6. Мінімальний радіус сфери, вписаної в тетрапорожнину | rt min | rt min = yt – R |
| 7. Мінімальний радіус сфери, вписаної в октапорожнину | ro min | ro min = yo - R |
| 8. Максимальний радіус сфери, вписаної в тетрапорожнину | rt max | rt max = rt min √3/2 |
| 9. Максимальний радіус сфери, вписаної в октапорожнину | ro max | ro max = ro min √3/2 |
Елементарний тетраедр і октаедр, утворені з щільної упаковки шарів халькогену або металу показані на рис. 4. Для сфалериту і в’юрциту кристалічна решітка складається з двох підрешіток утворених із атомів IIiVI груп періодичної системи. В такій решітці виникають вже два типи тетрапорожнин (t1, t2 ) і два типи октапорожнин (o1, o2 ), які відрізняються оточенням, тому розраховували радіуси ТП і ОП в оточені телуру і металу.
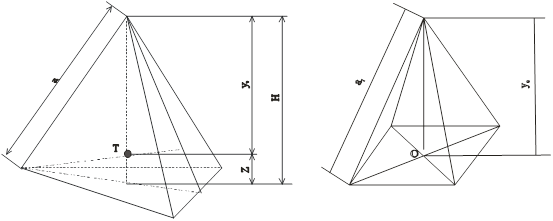
Рис. 4. Елементарний тетраедр (а), октаедр (б), утворені аніонною і катіонною упаковкою шарів: Т – центр тетраедра, О – центр октаедра, а1 – ребро тетраедра, h – висота тетраедра.
Геометричні характеристики тетра- і октапорожнин дозволяють визначити радіуси сфер (атомів) rt min , ro min (табл. 5), які в них можуть бути вписані. Існує обмеження на rt , ro , тобто радіуси вписаних сфер не можуть приймати значення, яке перевищує rt max , ro max . Їх можна визначити із порушення щільної упаковки сфер, коли вони не дотикаються одна до одної. Тоді проходить ніби збільшення ефективних розмірів сфер основної будови настільки, що, висота утвореного ними нового тетраедра h1 буде рівна або перевищить 2R. Так як h¢ = 2r¢ Ö2/3, тоді прирівнюючи h¢ = 2R, одержимо r¢ = rÖ3/2. Звідси можна знайти гранично допустиме значення радіусів сфер вписаних в порожнини rt max і ro max .[12].
В результаті такого геометричного представлення, враховуючи тип зв’язку в ряді досліджуваних сполук, тобто ковалентні і іонні (умовно) радіуси атомів, які приймають участь в утворені щільної упаковки визначили числові значення (мінімальні) тетраедричних і октаедричних порожнин на основі характеристик приведених в таблиці 5. Для сфалериту і в’юрциту одежані результати показані в табл. 6.
Таблиця 6
Розраховані радіуси тетраедричних і октаедричних порожнин для сфалериту і в’юрцитуОточення – халькоген
| Сполука | а, Ао | с, Ǻ | yt , Ǻ | rt к , Ǻ | rt і , Ǻ | yo , Ǻ | rо к , Ǻ | rо і , Ǻ | |
| СФАЛЕРИТ | |||||||||
| ZnS | 5,4093 | 2,3422 | 1,3222 | 0,5222 | 2,7046 | 1,6846 | 0,8846 | ||
| ZnSe | 5,668 | 2,4545 | 1,2945 | 0,5245 | 2,8343 | 1,6743 | 0,9043 | ||
| ZnTe | 6,1037 | 2,6429 | 1,2829 | 0,5329 | 3,0518 | 1,6918 | 0,9418 | ||
| CdS | 5,820 | 2,5200 | 1,530 | 0,73 | 2,91 | 1,550 | 1,09 | ||
| CdSe | 6,05 | 2,6196 | 1,4596 | 0,6895 | 3,025 | 1,865 | 1,095 | ||
| CdTe | 6,481 | 2,8063 | 1,4463 | 0,6963 | 3,2405 | 1,8805 | 1,1305 | ||
| В’ЮРЦИТ | |||||||||
| ZnS | 3,820 | 6,280 | 2,693 | 1,673 | 0,873 | 3,323 | 2,303 | 1,053 | |
| ZnSe | 4,003 | 6,540 | 2,18 | 1,16 | 0,36 | 3.468 | 2,308 | 1,538 | |
| ZnTe | 4,31 | 7,09 | 2,363 | 1,343 | 0,543 | 3,751 | 2,391 | 1,641 | |
| CdS | 4,1362 | 6,714 | 2,238 | 1,218 | 0,418 | 3,568 | 2,548 | 1,748 | |
| CdSe | 4,300 | 7,007 | 2,336 | 1,316 | 0,516 | 3,719 | 2,559 | 1,789 | |
| CdTe | 4,57 | 7,48 | 2,493 | 1,473 | 0,673 | 3,96 | 2,600 | 1,85 | |
Оточення – метал
| Сполука | а, Ǻ | с, Ǻ | yt , Ǻ | rt к , Ǻ | rt і , Ǻ | yo , Ǻ | rо к , Ǻ | rо і , Ǻ | |
| СФАЛЕРИТ | |||||||||
| ZnS | 5,4093 | 2,3422 | 1,062 | 1,512 | 2,7046 | 1,425 | 1,875 | ||
| ZnSe | 5,668 | 2,4545 | 1,174 | 1,624 | 2,8343 | 1,554 | 2,004 | ||
| ZnTe | 6,1037 | 2,6429 | 1,363 | 1,813 | 3,0518 | 1,772 | 2,222 | ||
| CdS | 5,820 | 2,5200 | 1,04 | 1,53 | 2,91 | 1,43 | 1,92 | ||
| CdSe | 6,05 | 2,6196 | 1,139 | 1,629 | 3,025 | 1,545 | 2,035 | ||
| CdTe | 6,481 | 2,8063 | 1,326 | 1,816 | 3,2405 | 1,761 | 2,251 | ||
| В’ЮРЦИТ | |||||||||
| ZnS | 3,820 | 6,280 | 2,693 | 1,413 | 1,863 | 3,323 | 2,043 | 2,493 | |
| ZnSe | 4,003 | 6,540 | 2,18 | 0,9 | 1,35 | 3.468 | 2,188 | 2,638 | |
| ZnTe | 4,31 | 7,09 | 2,363 | 1,083 | 1,533 | 3,751 | 2,471 | 2,921 | |
| CdS | 4,1362 | 6,714 | 2,238 | 0,758 | 1,248 | 3,568 | 2,088 | 2,578 | |
| CdSe | 4,300 | 7,007 | 2,336 | 0,856 | 1,346 | 3,719 | 2,239 | 2,729 | |
| CdTe | 4,57 | 7,48 | 2,493 | 1,013 | 1,503 | 3,96 | 2,48 | 2,97 | |
4. Кристалічна структура і антиструктура в телур иді кадмію
Телурид кадмію кристалізується в структурах сфалериту (S – кубічна структура В3), і в’юрциту (W – гексагональна структура В4) із однаковим числом атомів як в першій, так і в другій координаційних сферах [2, 9]. При кімнатній температурі і тиску 3,3-3,6 ГПа в телуриді кадмію проходить фазовий перехід із структури типу сфалерит в’юрцит у структуру типу NaCl, що супроводжується різким зменшенням електропровідності [20-22].
Із кристалічної будови цих структур відомо, що вони характеризуються тетраедричним оточенням атомів двох видів, і тетраедричними (ТП) та октаедричними (ОП) порожнинами яким належить ¼ всього простору упаковки атомів [3]. На рис. 2 (а,б) і 3 (а,б) представлено розміщення ТП і ОП в елементарній комірці структур сфалериту і в’юрциту. На одну комірку сфалериту припадає 4 ОП, 8 ТП; в’юрциту – 6 ОП, 12 ТП. Із рис. 2, 3 видно, що ТП в обох структурах заповнені наполовину, а ОП повністю не заповнені.
На основі геометричних уявлень, враховуючи тип зв’язку в CdTe (21% іонності) [5], тобто ковалентні (rк )та іонні (ri ) радіуси оточуючих атомів [10] розрахували радіуси ТП (rт ) і ОП (ro ) порожнин для оточення телуру і кадмію, які приведені в таблиці 7.
Таблиця 7
Радіуси тетраедричних (ТП) і октаедричних (ОП) порожнин для структур сфалериту та в’юрциту в підрешітці телуру (1), кадмію (2)
| Сполука | Структура | a, Å | c, | rк , Å | ri , Å | rк т , Å | ri т , Å | rк о , Å | ri о , Å |
1. СdTe CdTe | S W | 6,48 4,57 | 7,48 | 1,36 1,36 | 2,11 2,11 | 1,446 1,473 | 0,696 0,673 | 1,881 2,60 | 1,131 1,85 |
2. CdTe CdTe | S W | 6,48 4,57 | 7,48 | 1,48 1,48 | 0,99 0,99 | 1,326 1,013 | 1,816 1,503 | 1,761 2,48 | 2,251 2,97 |
Кристалоквазіхімічні підходи до запису хімічних формул і рівнянь грунтуються на правильному виборі антиструктури для даного класу сполук [18]. Для халькогенідів кадмію антиструктурою може бути природня “цинкова обманка” сульфід цинку, який кристалізуватися як в структурі сфалериту, так і в’юрциту.
Новизна кристалоквазіхімічного методу полягає в тому, що антиструктуру ![]() – сфалерит) накладають (суперпозиція, резонанс) на кристалохімічну формулу сполуки
– сфалерит) накладають (суперпозиція, резонанс) на кристалохімічну формулу сполуки ![]() . Де
. Де ![]() – двократно іонізовані негативні і позитивні тетраедричні вакансії металу (М) і аніону (А). Заряди дефектів в кристалоквазіхімії позначаються як: х – нейтральні, ×– позитивні, ¢ – негативні кількість цих знаків відповідає кратності іонізації, e' – концентрація електронів, h· – концентрація дірок.
– двократно іонізовані негативні і позитивні тетраедричні вакансії металу (М) і аніону (А). Заряди дефектів в кристалоквазіхімії позначаються як: х – нейтральні, ×– позитивні, ¢ – негативні кількість цих знаків відповідає кратності іонізації, e' – концентрація електронів, h· – концентрація дірок.
Така суперпозиція дає можливість ефективно аналізувати як самі процеси нестехіометрії, так і легування, утворення твердих розчинів, тощо. Розглянемо їх детальніше.
4.1. Кристалоквазіхімічний аналіз:
Нестехіометрія. При надлишку кадмію антиструктура стехіометричного сфалериту ![]() утворює кластер з катіонними вакансіями
утворює кластер з катіонними вакансіями
![]() (4.1)
(4.1)
Тоді при суперпозиції отриманого кластеру із квазіхімічною формулою стехіометричного складу отримаємо:
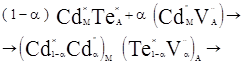
![]() (4.2)
(4.2)