Дипломная работа: Моделирование парожидкостного равновесия реакционной смеси в процессе получения метилциклопропилкетона
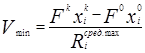
Таким образом, это выражение определяет нижнюю оценку объема реакционной зоны Vmin необходимого для достижения заданной производительности. Следовательно, можно утверждать, что необходимым условием достижения заданной производительности, является выражение
V > Vmin
где V- рабочий объем реакционной зоны.
Очевидно, что в отличии от необходимых условий, достаточные условия реализации в системе заданной конверсии не могут быть сформулированы без привлечения дополнительной информации о том, какой из способов формирования требуемого состава в реакционной зоне используется и какими ограничениями обладает массообменный процесс, осуществляющий селективный вывод продуктов реакции из реакционной зоны или системы в целом. Следует отметить, что в любом случае для достижения полной конверсии по реагентам (отсутствие реагентов на выходе из системы) необходимо использовать идеализированный массообменный процесс, позволяющий осуществлять полное отделение продуктов реакции от реагентов, которые должны быть тем или иным способов возвращены в реакционную зону.
Для описания математической модели парожидкостного равновесия (ПЖР) в реальных системах пользуются обобщенным уравнением Рауля: ![]() ,
,
где γi – коэффициент активности i-го компонента в жидкой фазе, а φi – коэффициент летучести i-го компонента в паровой фазе. φi = 1, если ассоциация в паре и Р< 5 атм. Состав пара и жидкости описывается единым термодинамическим состоянием
Р = P (V, T, ni …nn ) при V=const иV = V (P, T, ni …nn ) при P=const. Расчет ПЖР заключается в определении таких наборов (Т, Р, х) и (Т, Р, у) при которых выполняются условия фазового равновесия. Уравнения состояния применяются при расчете ПЖР смесей углеводородов некоторых компонентов нефти и природных газов. Поведение паровой и жидкой фаз описывается принципиально одинаковыми моделями. Вторая группа методов расчета состояния равновесия жидкость – пар включает расчет коэффициентов активности.
Коэффициенты активности получают из избыточных энергий Гиббса, однако на практике используют обратную процедуру: GE определяют из коэффициентов активности. Ниже приведены основные уравнения:
![]()
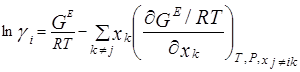
Корреляция избыточных энергий Гиббса имеют чисто эмпирический характер или же частичное теоретическое обоснование. Обычно состав выражают в мольных долях хi , однако, если молекулы значительно различаются по размерам и химической природе, лучше пользоваться объемными долями [3].
Эти уравнения указывают на тесную связь коэффициентов активности с избыточной энергией Гиббса GE [7]. Были предложены многочисленные модели, включающие в себя настраиваемые параметры, которые зависят от температуры. В некоторых случаях этой зависимостью можно пренебречь, особенно если температурный интервал невелик. На практике число настраиваемых констант в расчете на бинарное взаимодействие обычно равно двум или трем; чем больше число констант, тем лучше будет представление экспериментальных данных, однако в то же время потребуется большое количество надежных экспериментальных данных для определения констант. Чтобы получить константы для бинарной смеси при определенной температуре числом более трех, необходимо иметь подробные и исключительно точные экспериментальные данные.
Для умеренно неидеальных бинарных смесей хорошие результаты дают все уравнения, содержащие два (или более) параметра бинарного взаимодействия; в таких случаях нет смысла разбирать преимущества той или иной модели. Следует только отметить, что старые модели (Маргулеса, Ван-Лаара) математически проще, чем более современные (Вильсона, NRTL, UNIQUAC).
Уравнение Маргулеса является наиболее старым из числа применяемых в настоящее время. Исследования Маргулеса были выполнены еще до того, как были сформулированы такие понятия, как фугитивность и коэффициенты активности, однако в сущности его предложения сводятся к представлению lnγ1 и lnγ2 в виде степенных рядов по составу:
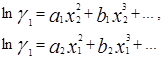 для двухкомпонентных смесей.
для двухкомпонентных смесей.
Как правило, применяют линейные перегруппировки этих рядов, предложенные Карлсоном и Кольборном [3]:
![]()
![]()
в которых существует постоянная зависимость между параметрами и коэффициентами активности при бесконечном разбавлении:
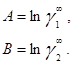
Избыточная энергия Гиббса, соответствующая этим уравнениям, составляет
![]()
Двухчленное (однопараметрическое) уравнение Маргулеса применимо только для простых смесей, в которых компоненты похожи по химической природе и размеру молекул [4].
Ван-Лаар рассмотрел изобарный процесс образования жидкого раствора из компонентов, включающий стадии испарения чистых веществ, их смешения в разреженном идеальном газовом состоянии и последующего сжатия и конденсации смеси до исходного давления. Он допускал нулевые значения избыточных объемов и энтропии процесса (соответственно, избыточная энергия Гиббса равна избыточной внутренней энергии) и подчинение флюидных фаз уравнению состояния Ван-дер-Ваальса, причем константы этого уравнения для смесей он представил с помощью простых комбинационных правил на основе констант для чистых компонентов [7]. Ван-Лаар просуммировал изменение внутренней энергии на отдельных стадиях процесса образования раствора, результат может быть представлен в виде следующих уравнений для GE и γi в бинарной системе:
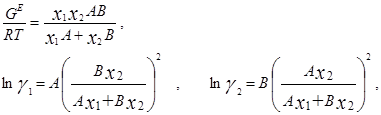
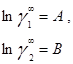
В модели Ван-Лаара величины А, В аналитически связаны с константами уравнения Ван-дер-Ваальса, однако выяснилось, что последние не обеспечивают адекватное описание систем, в частности, из-за большой чувствительности модели к произвольно выбранным комбинационным правилам для констант уравнения состояния. Если же рассматривать величины А, В как самостоятельные эмпирические параметры, оцениваемы по экспериментальным данным о бинарной системе, тогда соотношения превращаются в простые корреляционные уравнения, удовлетворительно описывающие многие системы[7].
Точность представленных выше моделей обычно удовлетворительна для систем малой или умеренной неидеальности и недостаточна для систем с большими отклонениями от идеального поведения.