Дипломная работа: Постановка методики определения таурина с целью изучения обменных процессов в мягких контактных
Образующееся соединение имеет фиолетово-синюю окраску (λ max=570 нм). Нингидриновая реакция неспецифична, так как окрашенный продукт с нингидрином дают также NH3 и другие соединения, содержащие аминогруппу (в том числе белки и пептиды). Однако реакции с этими соединениями осуществляются без выделения СО2 (нингидриновая реакция с выделением СО2 специфична только для α-аминокислот). Реакцию используют для колориметрического количественного определения α-аминокислот, в том числе в автоматических аминокислотных анализаторах [18].
Конечным продуктом является фиолетовый (пурпурный) Руэмана. Казалось бы, что во всех случаях окраска раствора должна быть одинаковой. Однако возможны и другие процессы, как, например, взаимодействие образовавшихся альдегидов (побочные продукты) с аминокислотами, приводящие к появлению по-разному окрашенных продуктов [18].
В работе [19] предлагается другой механизм нингидриновой реакции:
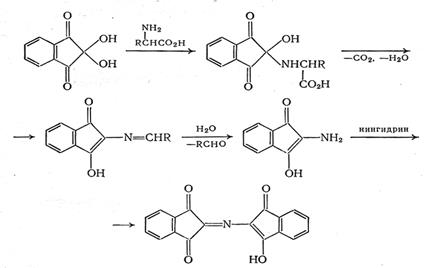
Выход продукта реакции зависит от свойств определяемой аминокислоты. Наиболее интенсивные окраски при прочих равных условиях наблюдаются при определении глицина, изолейцина, лейцина, норлейцина; несколько менее интенсивная окраска - при реакции с серином, фенилаланином, цистеином. Величины e510 [18] продуктов реакции лежат в пределах 1,8·104-3,3·104. Окрашенные продукты реакции нестабильны, и интенсивность окраски раствора довольно быстро уменьшается. Для стабилизации в состав реактива вводят хлорид кадмия, который с фиолетовым Руэмана образует устойчивые комплексные соединения. Присутствие кадмия влияет также на скорость реакции и на спектральную характеристику продукта. Хлорид кадмия можно заменить разбавленным раствором сульфата меди, который с фиолетовым Руэмана образует оранжево-красное соединение с lmax=530 нм.
Таким образом, значения молярного коэффициента поглощения продуктов реакции с нингидрином зависят от условий и в расчете на определяемое вещество, в зависимости от выхода реакции, составляют п·103 - 20·103.
В целом, для нингидриновой реакции характерна высокая чувствительность, поскольку отдельные ее стадии отличаются хорошими выходами и воспроизводимостью.
В работе [18] приведен также ряд методических рекомендаций для определения α-аминокислот, в том числе и таурина:
I. Смешивают 1 мл раствора, содержащего 0,02—0,4 мг α -аминокислоты, с 0,5 мл буферного раствора (рН 5,3—5,4) и 0,5 мл 3%-ного раствора нингидрина в метилцеллозольве. Нагревают 15 мин при 100°С, после чего добавляют 5мл 50%-ного изопропилового спирта и взбалтывают. После охлаждения до комнатной температуры красный раствор фотометрируют при 570 нм. Таким способом определяют аланин, аспарагиновую кислоту, аспарагин, валин, глицин, глутамин, глутаминовую кислоту, гистидин, изолейцин, лизин, орнитин, метионин, серии, таурин, треонин, тирозин, фенилаланин, этаноламин, а также аммиак. При определении пролина и оксипролина получают желтый раствор, который фотометрируют при 440 нм. Для приготовления буферного раствора растворяют 270 г ацетата натрия в 200 мл воды, добавляют 50 мл ледяной уксусной кислоты и воду до 750 мл. К 500 мл этого раствора добавляют 10 мл 0,01 М раствора NaCN.
II. Раствор в 80%-ном этиловом спирте, содержащий около 5 мкг аминокислоты, смешивают с 2 мл 0,2%-ного раствора нингидрина в изобутиловом спирте и этим же спиртом разбавляют до объема 10 мл. Нагревают 3 мин при 80єС, затем охлаждают до 22єС и фотометрируют при длинах волн от 530 до 560 нм. Так определяют аланин, аспарагин, валин, глицин, изолейцин, лизин, фенилаланин и ряд других аминокислот.
III. К 1 мл анализируемого раствора прибавляют 1 мл ледяной уксусной кислоты и 1 мл