Дипломная работа: Проектирование производства фосфорсодержащего вещества
Представляет собой бесцветную, прозрачную, подвижную жидкость склонную к самопроизвольной полимеризации. Для ее предотвращения необходима стабилизация продукта гидрохиноном (около 1% масс.).
Метанол (карбинол) СH3 ОН:
Бесцветная легкоподвижная жидкость с характерным запахом этилового спирта.
Молекулярная масса 32,04;
Плотность 0,7923;
Температура плавления -97,8 °С;
Температура кипения 64,7 °С;
Неограниченно растворим в воде, этиловом спирте и эфире.
Физико-химические основы технологических процессов
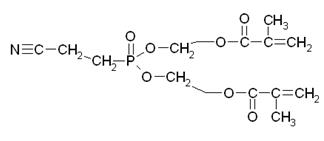
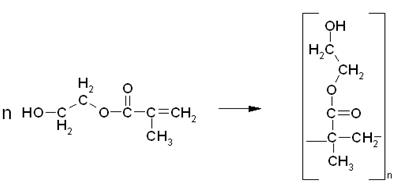
Основная реакция, протекающая в данном технологическом процессе – переэтерификация. Ее механизм представлен ниже:
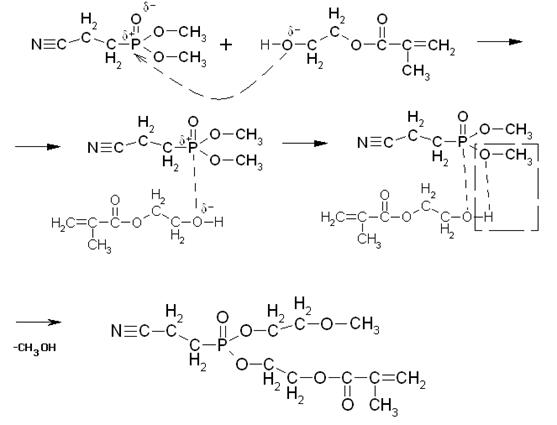
Кислородный атом имеет свойство оттягивать на себя электронную плотность с соседних менее электроотрицательных атомов. В связи с этим, на атоме кислорода образуется частичный отрицательный заряд δ- , а на атоме фосфора – положительный δ+ .
Атом кислорода гидроксильной группы в молекуле МЭГ также имеет частичный отрицательный заряд δ- , и под действием сил электростатического притяжения приближается к атому фосфора, имеющему противоположный заряд.
Таким образом, образуется новая связь между атомом фосфора и кислородом МЭГ. Причем эта связь более сильная, чем имеющаяся в эфире связь Р-О, которая ослабляется, и в конечном итоге разрывается, при этом образуется продукт неполной переэтерификации и молекула метанола.
Далее со второй молекулой МЭГ механизм аналогичен:
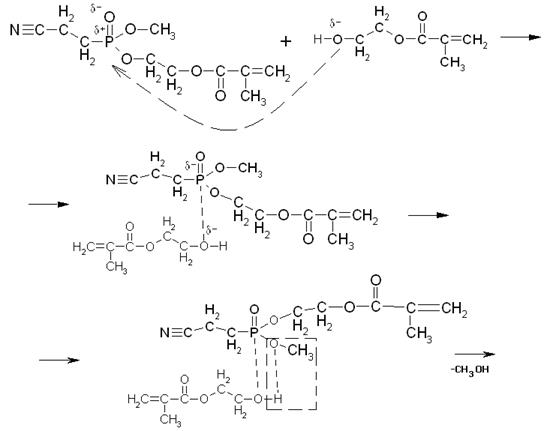
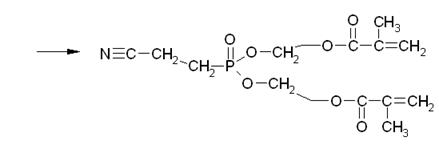
Таким образом, в результате переэтерификации может образоваться и побочный продукт неполной переэтерификации.
Кроме того, в системе также могут протекать и другие побочные реакции, например, полимеризация МЭГ, полимеризация продукта переэтерификации и т.д.:
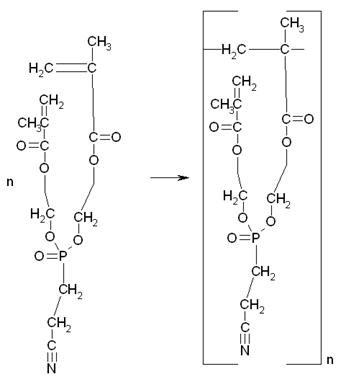
Таким образом, в реакционной смеси может присутствовать, как продукт полной переэтерификации, так и продукт неполной, а также полимеры и олигомеры 2-гидроксиэтилметакрилата, и продукта переэтерификации.
Определенный согласно закону Гесса, тепловой эффект реакции составляет -10986,9 Дж/моль, реакция протекает с поглощением тепла.
Кинетические закономерности переэтерификации рассмотрены. Более подробно в литературе рассматриваются реакции переэтерификации в присутствии катализаторов (третичные и четвертичные амины, а также большое число различных солей металлов). Катализаторами переэтерификации является множество веществ самого разного характера, что позволяет отнести описываемый процесс к реакциям кислотно-основного типа катализа, в котором имеет место промежуточное кислотно-основное взаимодействие реагирующих веществ с катализатором, т. е. переход протона от катализатора к одному из реагирующих веществ или, наоборот, от реагирующего вещества к катализатору. При последующих стадиях протон перемещается обратно, и катализатор восстанавливает свой состав. Случай катализа недиссоциированными молекулами является частным случаем кислотно-основного катализа.
На рис. 2 приведены кинетические кривые хода переэтерификации при разных температурах для смешанного катализатора, состоящего из ацетата цинка и окиси свинца [27]. Практически реакция переэтерификации, о ходе которой, чаще всего, судят по выделению метилового спирта, не начинается ниже 150 °С. Только при 175 °С и выше достигается достаточно высокая степень конверсии.
Реакция переэтерификации с различными катализаторами может заканчиваться на разном кажущемся равновесии. Последнее объясняется потерей активности катализатором в ходе процесса. Для соединений с различными катионами потеря активности не одинакова.
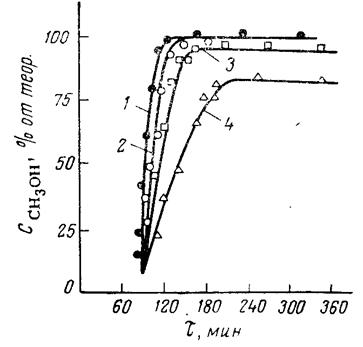
Рис. 3. Кинетика переэтерификации при различных температурахс катализатором Zn(OAc)2 + PbO (0,2%) 1 – 215 °С; 2 – 200 °С; 3 – 175 °С; 4 – 152 °С;