Дипломная работа: Синтез этилового спирта
Степень превращения этилена за один проход через реактор составляет 3,5—4,8%. Непрореагировавший этилен возвращается в реактор (рециркулирует), пары воды и спирта конденсируются в системе теплообменников и холодильников, а циркулирующий газ при этом охлаждается. Водно-спиртовый конденсат отделяют от циркулирующего газа в сепараторах и направляют на ректификацию. Из всего количества этилена, вступившего вреакцию, только 95—98,5% превращается в спирт, а остальное — в диэтиловый эфир, ацетальдегид, полимеры. С целью повышения степени превращения этилена в спирт поддерживают высокую концентрацию этилена в циркулирующем газе (90% масс, и более). При этом необходимо, чтобы концентрация этилена в свежей этиленовой фракции, поступающей с газоразделительной установки, была равна 99% (масс).
При ректификации водно-спиртового конденсата из него получают 93—94%-ный спирт. Из выделенного концентрированного спирта удаляют небольшие количества ацетилена.
2.2 Кинетика и термодинамика процесса.
Рассмотрим равновесие основной реакции: гидратации - внутримолекулярной дегидратации:
![]()
![]() Н2 С=СН2 + Н2 О Н2 СОН – СН3
Н2 С=СН2 + Н2 О Н2 СОН – СН3
Она протекает с выделением тепла, следовательно ее равновесие смещается вправо при понижении температуры. Дегидратации, наоборот, способствует нагревание. Равновесие невыгодно для гидратации олефинов, так как при 150-300о С, когда катализаторы процесса достаточно активны, DGо имеет большую положительную величину и равновесие смещено в сторону дегидратации. При этом для олефинов разного строения различия в термодинамике рассматриваемых реакций незначительны. Как показывает стехиометрия реакций, на их равновесие можно влиять, изменяя давление. Внутримолекулярной дегидратации, идущей с увеличением числа молей веществ, способствует пониженное или обычное давление. Наоборот, гидратации олефинов (в том числе и этилена) благоприятствует высокое давление, увеличивающее равновесную степень конверсии олефина. Так, последняя при 250-300о С и атмосферном давлении составляет всего 0,1-0,2%, что совершенно неприемлемо для практических целей, но при 7-8 Мпа и тех же температурах она возрастает до 12-20 %. Зависимость равновесной степени конверсии этилена при его гидратации от давления и температуры изображена на рис.2, причем аналогичные кривые характерны и для других олефинов. Очевидно, что гидратации способствует одновременное снижение температуры и повышение давления.
Рассмотрим теперь равновесие в системемежмолекулярная дегидратация спиртов - гидролиз простых эфиров:
![]()
![]() 2ROHROR + Н2 О
2ROHROR + Н2 О
В случае этанола ее равновесие описывается уравнением
![]()
показывающим, что оно смещается вправо при снижении температуры. Следовательно, при 200-400о С внутри- и межмолекулярная дегидратация конкурируют друг с другом. Термодинамическим методом регулирования направления этих реакций является изменение давления: на образование простого эфира оно не влияет, но получению олефина его снижение благоприятствует.
В ряде случаев роль воды более сложная. Так, фосфорная кислота, нанесенная на пористый носитель, образует на его поверхности жидкую пленку, которая абсорбирует воду из газовой фазы. При каждых данных температуре и парциальном давлении водяных паров в газовой фазе устанавливается фазовое равновесие, и фосфорная кислота в пленке имеет определенную концентрацию и соответствующую ей каталитическую активность. Последняя падает при снижении температуры и росте парциального давления воды, что ограничивает выбор этих параметров для каждого случая определенными рамками.
2.3 Влияние основных параметров на скорость процесса.
2.3.1 Температура.
Реакцию прямой гидратации этилена желательно проводить при невысоких температурах. Однако практически выбор температуры лимитируется скоростью реакции и активностью применяемых катализаторов.С повышением температуры, при прочих равных условиях, равновесная степень превращения этилена в спирт снижается. Однако при низких температурах активность фосфорнокислотного катализатора очень мала. Так, степень конверсии этилена при 280-290о С достигает лишь 4-5%, а при более низких температурах она еще меньше.На практике процесс прямой гидратации в паровой фазе в присутствии фосфорнокислотного катализатора ведут в интервале 260-300о С.
С повышением температуры до 290 °С скорость гидратации этилена возрастает. Дальнейшее повышение температуры до 320 °С сопровождается незначительным снижением степени конверсии этилена в этиловый спирт; кроме того, при этом резко возрастает выход побочных продуктов. Зависимость текущей производительности реактора по спирту (Gc п ) оттемпературы (Т, К) в верхней части аппарата описывается эмпирическим уравнением:
![]()
где а, b , с – коэффициенты, зависящие от активности катализатора и от технологических параметров процесса. Каждому моменту времени соответствует оптимальная температура, обеспечивающая максимальные текущую и суммарную производительность аппарата при минимальной себестоимости спирта. Отклонение температуры от оптимальной на 5°С приводит к снижению производительности реактора на 5%; при этом соответсвенно возрастает расход пара, электроэнергии и катализатора на 1 т спирта. Оптимальная температура (Т, К) верха реактора, в соответствии с литературными данными, определяется по формуле:
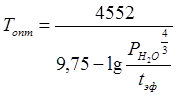
где Рн2 о — парциальное давление паров воды в реакторе, кгс/см2 ; t эф - эффективное время реакции, с. Использование этого уравнения для регулирования температуры верха аппарата осложняется трудностью определения t эф длякаждого момента работы реактора.
2.3.2 Влияние давления.
Повышение давления благоприятствует реакции гидратации, причем оптимальное давление составляет 6,7-8 Мпа . Это давление связано с процессом абсорбции этилена фосфорной кислотой. Оптимальное парциальное давление водяных паров равно 2,7-3 Мпа ; оно и определяет мольное соотношение водяных паров и этилена. Оптимальное парциальное давление этилена составляет 3,5-3,7 Мпа. Общее давление складывается из парциальных давлений воды, этилена и примесей. При концентрации этилена в циркулирующем газе 80-85% общее давление системы получается равным 7-8 Мпа.
2.3.3 Концентрация исходных веществ (реагентов).
Повышение концентрации этилена в циркулирующем газе при постоянной циркуляции способствует повышению производительности реактора и снижению расхода пара, электроэнергии и катализатора на 1 т спирта. В то же время для поддержания более высокой концентрации этилена в газе необходимо увеличивать долю газа, выводимого из системы для удаления инертных примесей, а это отрицательно влияет на себестоимость спирта. Оптимальной концентрацией этилена в циркулирующем газе является 90-92% (об.). повышение концентрации этилена сверх 93% (об.) нецелесообразно, так как это значительно увеличивает себестоимость спирта.
![]()
2.3.4 Влияние мольного соотношения воды и этилена.
Согласно термодинамическим данным, с увеличением отношения Н2 О : С2 Н4 c 0,5:1 до 1 : 1 значительно повышается степень конверсии олефина. Однако экспериментальные данные отличаются от термодинамических: с увеличением отношения Н2 О : С2 Н4 до 0,7-0,75 степень конверсии этилена действительно возрастает, но при дальнейшем его увеличении она снижается.
Установлено также, что от соотношения Н2 0 : С2 Н4 зависит и активность катализатора гидратации. Оптимальная концентрация фосфорной кислоты в жидкостной пленке на пористом носителе составляет 83-85%. Эта величина зависит от парциального давления водяного пара, которое определяется общим давлением в системе и мольным отношением вода : этилен. Оптимальная концентрация Н3 РО4 наблюдается при соотношении Н2 О : С2 Н4 = 0,75:1. С дальнейшим ростом этого соотношения возрастает количество воды в пленке, уменьшается концентрация кислоты и снижается степень конверсии этилена. Поэтому в промышленных условиях принято мольное соотношение Н2 О : С2 Н4 =(0,6-0,7) : 1.
2.3.5 Катализаторы
Промышленные катализаторы должны удовлетворять ряду требований, предъявляемых технологией. Катализаторы должны быть активными к данной реакции, возможно более стойкими к действию контактных ядов, сравнительно дешевыми, обладать высокой механической прочностью, термостойкостью, определенной теплопроводностью и т.п. Поэтому применяемые на практике катализаторы редко являются индивидуальными веществами и, как правило, представляют собой сложные механические смеси, называемые контактными массами. В состав контактной массы входят в основном три составные части: собственно катализатор, активаторы и носители.
Носителями называются термостойкие инертные пористые вещества, на которые тем или иным способом наносят катализатор. Использование носителей преследует как технологические, так и экономические цели. Во-первых, при этом создается пористая контактная масса с богато развитой внутренней активной поверхностью, увеличивается ее механическая прочность и термостойкость, во-вторых экономится дорогой катализатор (платина, никель, пятиокись ванадия и т.п.). В некоторых случаях сами носители могут быть активаторами. К типичным носителям катализаторов относятся силикагель, алюмосиликат, асбест, пемза, кизельгур, уголь, каолин, некоторые соли.