Дипломная работа: Синтез и исследование сорбционных свойств гуанидинсодержащих полимерных нанокомпозитов
2Si4+ 8+
6O 12-
2Si4+ 8+
2(OH)- 2-
Межслоевые Н2 О или другие полярные группы
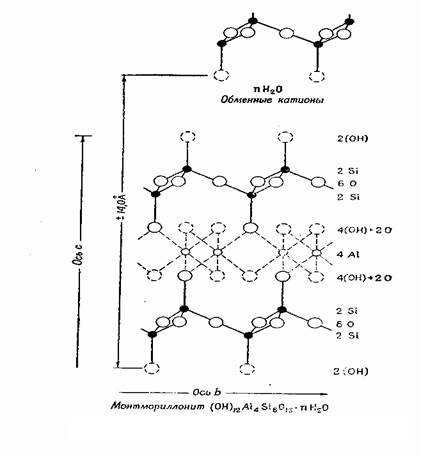
Рис. 1.4. Схематическое изображение структуры монтмориллонита
(по Эдельману и Фавейе)
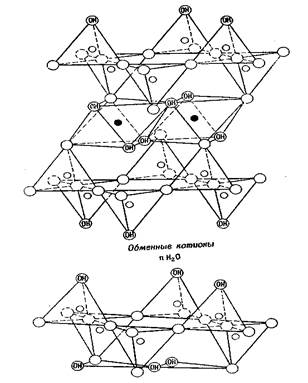
Рис. 1.5. Схематическое перспективное изображение структуры монтмориллонита (по Эдельману и Фавейе)
Этому соответствует структурная формула (OH)12 Si8 Al4 016 • nН2 0 (межслоевая вода). Для этой структуры нет необходимости предполагать какие-либо замещения в пределах решетки для объяснения обменной способности. Решетка может быть полностью уравновешена. Как полагают авторы, обменная реакция связана, прежде всего, с замещением атомов Н из групп ОН, расположенных в наружных вершинах тетраэдров. Согласно первоначальной модели монтмориллонита число таких групп ОН значительно превышало количество их, требуемое значением емкости обмена. Эдельман и Фавейе [36] вынуждены были предположить, что лишь часть их доступна для обмена. Как следует из рентгеновских данных, основанных на синтезах Фурье [36], данных химических анализов, указывающих на наличие изоморфных замещений, и тщательных исследований дегидратации монтмориллонита, структура этого минерала, по Эдельман у и Фавейе, в своем первоначальном варианте [37] не соответствует действительности. Впоследствии Эдельман [38] предложил видоизмененную структурную схему монтмориллонита, согласно которой лишь 20% тетраэдров являются обращенными, что ликвидирует расхождение с экспериментальными значениями емкости обмена. Весьма сомнительно, смогут ли рентгеновские данные подтвердить справедливость этой видоизмененной структурной модели. Такая структура монтмориллонита не совсем согласуется с химическими данными, указывающими на наличие изоморфных замещений, и с геометрией поглощения органических молекул. Характер метиляции отдельных органических веществ при их поглощении монтмориллонитом, указывающий на большее число групп (ОН), чем это совместимо со структурой монтмориллонита, по Гофману и др. [27], заставил некоторых исследователей (Бергер [35], Дуэлл [36]) отдать предпочтение этой структуре. Необходимы Дальнейшие исследования для выяснения возможных структурных изменений, связанных с такими органомонтмориллонитовыми реакциями.
Мак-Коннелл [33] несколько видоизменил структуру монтмориллонита, предложенную Гофманном и др. [27]. Он предположил, что некоторые кремнекислородные тетраэдры структуры замещены тетраэдрами (ОН)4 — что равносильно предположению о наличии пробелов в размещении атомов кремния по тетраэдрическим положениям — с соответствующей заменой атомов О группами ОН для сохранения баланса в структуре. Это должно обеспечить избыточное количество поверхностных групп ОН, необходимое для объяснения некоторых особенностей поглощения органических веществ монтмориллонитом, а также согласуется с данными дегидратации монтмориллонита. Необходимы дальнейшие исследования для подтверждения предположений Мак-Коннелла.
1.3 Органомодификация монтмориллонита
Особый интерес для получения нанокомпозитов представляют минералы, способные к разбуханию (смектиты) [6, 25, 26]. Один из представителей смектитов - монтмориллонит, характерной особенностью которого является способность набухать в некоторых растворителях и диспергироваться на отдельные нанослои при определенной обработке.
Катионы металлов, находящиеся в природном минерале, могут заменяться на другие ионы при проведении реакции ионного обмена. По способности к замещению они могут быть расположены в следующий ряд [39-41]:
А1> Са>К> [(C4 H9 )4 N]> [(C2 H5 )4 N]> [(СНз)4 N]>NH4 >Na> Li
Как отсюда следует, четвертичные алкиламмониевые катионы могут вытеснять ионы Na+ с обменных позиций в монтмориллоните, причем увеличение числа углеродных атомов в неполярных алифатических группах способствует более эффективному вытеснению межслоевых катионов [41]. В связи с этим, чаще всего в качестве модификаторов поверхностных свойств глины используют катионные поверхностно-активные вещества (ПАВ), в которых число углеродных атомов составляет от 6 до 20.
Все глинистые минералы обладают определенной емкостью катионного обмена (ЕКО). Эта величина обозначает количество обменных катионов (выраженное в мг-эквивалентах), способных к замещению на катионы другого типа в расчете на 100 г глины. Монтмориллонит обладает самой высокой среди глинистых минералов емкостью катионного обмена (до 150мг.экв/100г).
Способность катионов металлов в межслоевых пространствах замещаться на катионные ПАВ позволяет модифицировать поверхностные свойства силикатных пластин [42]. Для придания гидрофильным глинам органофильности используют ПАВ с длинными алифатическими цепями. Модифицированная в результате хемосорбции глина (или органоглина) являясь органофильной, имеет меньщую поверхностную энергию и лучше совмещается с органическими полимерами. Когда межплоскостные катионы после ионного обмена замещены более объемными алкиламмониевыми органическими катионами, происходит также и увеличение межслоевого расстояния.
Процессы сорбции органических катионов на глинистых минералах, в том числе на монтмориллоните изучаются уже сравнительно давно [42]. Поскольку в слое силиката присутствует отрицательный заряд, катионная концевая группа алкиламмониевого катиона предпочтительней располагается на поверхности слоя, оставляя алифатическую цепь направленной от или вдоль поверхности. Как отмечено в работе [43], обмен ионов сложных органических соединений во многом отличается от обычного обмена ионов металлов, так как наряду с электростатическим взаимодействием поверхности минерала и иона, проявляется действие ван-дер-ваальсовых сил. В этой же работе указывается и на возможность образования слоев органических катионов внутри межпакетных пространств монтмориллонита. Они могут располагаться более чем одним слоем, так как одного слоя объёмных катионов может быть недостаточно для нейтрализации заряда на поверхности пластин. В результате сорбции объемных органических катионов и десорбции малых ионов натрия, происходит увеличение межплоскостного расстояния между пластинами глины [44, 45].
Межплоскостное расстояние в органоглинах также зависит от ЕКО слоистого силиката. Количество обменных позиций на поверхности силикатных пластин определяет плотность упаковки молекул модификатора.
Как видно из рисунка 6, межпакетное расстояние монтмориллонита увеличивается ступенчато в зависимости от количества атомов углерода в цепи модификатора первичного амина.
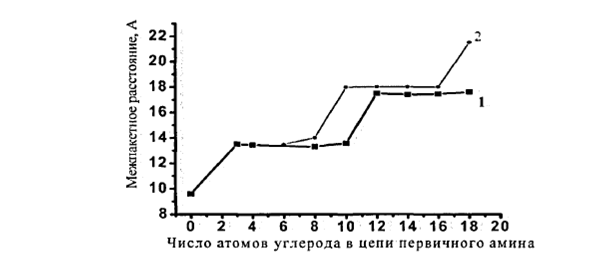
Рис.1.6. Изменение межпакетного расстояния монтмориллонита, модифицированного первичным амином, в зависимости от числа углеродных атомов в цепи амина Ио емкости катионного обмена: 1- малые ЕКО (< 90 мг·экв/100г; 2- большие ЕКО (>90 мг·экв/100г)
Для глин, имеющих различное количество обменных позиций, увеличение межпакетного расстояния при эквивалентной сорбции алифатических аминов с длиной цепи от 1 до 3 метильных групп происходит на величину ~ 0,4 нм (см. рис. 6). Это межплоскостное расстояние примерно равно диаметру алифатических цепей, которые располагаются параллельно пластинам слоистого силиката (рис. 3, а). При дальнейшем увеличении количества метильных групп в алифатических цепях вновь происходит возрастание величины межпакетного расстояния на ~ 0,4 нм при длине углеродной цепи 8-10 атомов для силикатов с малым значением ЕКО и 16-18 для силикатов с большой ЕКО (>90мг*экв/100г). Это может соответствовать переходу алкильных цепей модификатора, находящихся в межслойном пространстве от монослоя к бислою, а затем к образованию псевдотройного слоя. На рисунке 3 показано изменении структуры слоев модификатора [46]. По-видимому, алифатические цепи таких модификаторов способны образовывать бислои, также лежащие параллельно поверхности частицы.
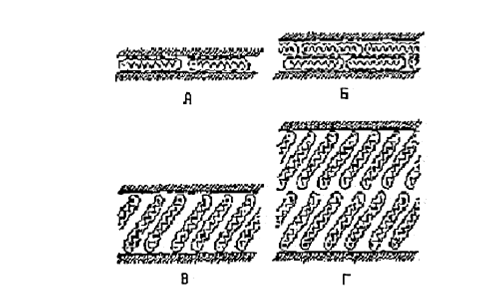
Рис.1.7. Агрегация алкильных цепей в слоистых силикатах:а)горизонтальный монослой; б)горизонтальный бислой;в) монослой «парафинового типа» 3) бислой «парафинового типа»[46]
Авторы работы [48] предполагают, что в случае