Дипломная работа: Сравнительный анализ: методы получения синтез-газа
Были попытки использовать и ряд других технических решений для создания новых газогенераторов: использование внешнего теплоносителя, в том числе тепла ядерного реактора; газификация в расплавах солей, железа, шлака; двух - трехступенчатая газификация; газификация в плазме; каталитическая газификация и др., но они не привели к созданию современного конкурентоспособного технологического процесса.
4. Конверсия метана в синтез-газ
Углекислотная конверсия метана в синтез-газ СО + Н2 - одна из важнейших химических реакций, пригодная для промышленного получения водорода и дающая начало синтезу углеводородов (жидкое топливо) и других технически ценных продуктов.
Существует три метода окислительной конверсии метана в синтез-газ:
· паровая конверсия
CH4 + H2 O ↔ CO + 3H2
ΔН = +206 кДж/моль (1)
· парциальное окисление кислородом
CH4 + 1/2O2 ↔ CO + 2H2
ΔН = -35,6 кДж/моль (2)
· углекислотная конверсия
2CO + 2H2 ↔ CH4 + CO2
ΔН = +247 кДж/моль (3)
В промышленности используется практически лишь метод паровой конверсии (1). Реакцию проводят на нанесенном Ni-катализаторе при высокой температуре (700 - 900 °С). Что касается реакции (2), то на ее основе фирмой «Shell» был разработан технологический процесс в некаталитическом варианте при очень высоких температурах (1100 - 1300 °С), реализованный на небольшом заводе в Малайзии. Заметим, что по последним сведениям из-за аварии этот завод сейчас не работает. Реакция (3) пока находится в стадии исследования на уровне лабораторных и пилотных испытаний. Как следует из уравнений (1) - (3), количественный состав образующегося синтез-газа в этих реакциях различный: в реакции (1) получается синтез-газ состава СО:Н2 = 1:3, в реакции (2) - смесь 1:2, в реакции (3) - смесь 1:1. Потребность в синтез-газе того или иного состава определяется его последующим техническим назначением.
Так, для синтеза метанола требуется синтез-газ состава 1:2
СО + 2Н2 = СН3 ОН (4)
В производстве аммиака из азото-водородной смеси на стадии ее получения применяют синтез-газ состава 1CO:3H2 . Относительно недавно предложено использовать синтез-газ состава 1:1 для промышленного получения диметилового эфира [9, 10]. Формальная стехиометрия этой реакции соответствует уравнению
2СО + 4Н2 = СН3 ОСН3 + Н2 О (5)
Однако, с учетом того, что в условиях этого процесса H2 O вступает во взаимодействие с CO (паровая конверсия CO)
CO + H2 O ↔ CO2 + H2
ΔH = - 41 кДж/моль(6)
реально для получения диметилового эфира требуется смесь CO:H2 состава 1:1:
3СО + 3Н2 = СН3 ОСН3 + СО2 (7)
Термодинамическое рассмотрение реакции (7) указывает, что она может осуществляться при давлениях значительно меньших, чем реакция (4). Катализатором реакции (7) может служить комбинация катализаторов дегидратации и синтеза метанола. Получаемый диметиловый эфир предлагается применять в качестве топлива в дизельных двигателях без переделки самих двигателей (это топливо резко снижает вредные выхлопы ─ «топливо 21 века», как его назвали разработчики).
4.1 Термодинамика процесса
Равновесие в системе 2CO + 2H2 ↔ CH4 + CO2
Большие трудности в практическом осуществлении всех методов конверсии метана связаны со значительным тепловым эффектом: как эндотермичность реакций (1) и (3), так и экзотермичность реакции (2) создают проблему подвода или отвода тепла. В углекислотной конверсии метана (3) при 700 - 800 °С на многих никелевых и платиновых катализаторах достигается равновесная конверсия в синтез-газ СО + Н2 . В этих условиях одновременно с реакцией (3) осуществляется взаимодействие монооксида углерода с водяным паром (6). Протекание реакции (6) приводит к тому, что в равновесии (3) отношение СО:Н2 оказывается меньше 1, а конверсия СО2 больше конверсии СН4 . Лишь при 900 °С и атмосферном давлении выход Н2 и СО приближается к 100%, а отношение Н2 О/СО к нулю.
На рис. 11 показана зависимость равновесного выхода Н2 и СО в исходной системе CH4 + CO2 от температуры и давления.
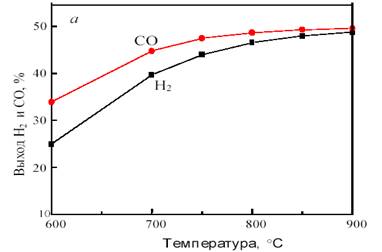
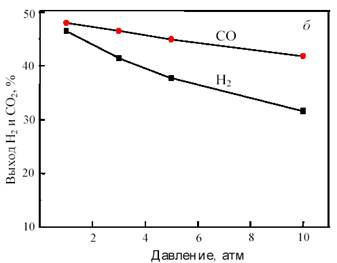
Рис. 11. Зависимость равновесного выхода Н2 и СО от температуры при 0,1 МПа (а) и от давления при 800 °С (б) в исходной смеси 1СН4 :1СО2
Как видно из рис. 11, с повышением температуры выход водорода и CO возрастает, достигая предела вблизи 900 °С. С ростом давления равновесная конверсия уменьшается.