Дипломная работа: Сравнительный анализ: методы получения синтез-газа
· диссоциация метана
СН4 = С + 2Н2
ΔН = +74,8 кДж/моль•С (8)
· реакция Будуара
2CO ↔ C + CO2
ΔН = -172,5 кДж/моль•С (9)
Первая из них ─ эндотермическая, вторая ─ экзотермическая. Обе реакции могут быть представлены как стадии суммарной реакции (3). Однако в реальности они протекают при разных температурах: реакция (8) ─ преимущественно при высоких температурах, реакция (9) ─ при низких температурах, и в реальных условиях кокс почти всегда образуется. Согласно термодинамическим соображениям суммарное углеотложение должно снижаться с повышением температуры. Действительно, эксперимент подтверждает, что основное количество углерода образуется по реакции (8), а не (9). Часто углерод, диффундируя в металл, образуется на выходе из катализатора в виде нитей.
Одним из путей решения проблемы, связанной с подводом и отводом тепла при получении синтез-газа, является разработка процесса комбинированной конверсии смеси СН4 + СО2 + Н2 О + О2 , в котором бы без дополнительного подогрева сочетались реакции (1), (2), (3) и (6). Такую термонейтральную (автотермическую) конверсию можно осуществить, комбинируя углекислотную (3) и кислородную (2) конверсию метана в системе СН4 + СО2 + О2 . Термодинамический расчет процесса комбинированной конверсии, включающей реакции (2), (3) и паровой конверсии СО (6), показывает, что в смеси 50% СН4 + (50 - х)% СО2 + х% О2 при 800 °С термонейтральность достигается при х = 23% (рис. 12). В реакции смеси 50% СН4 + 27% СО2 + 23% О2 при 800 °С и 1 атм. равновесные выходы составляют: 49,3% Н2 и 36,5% СО, т.е. соотношение CO:H2 сильно отличается от единицы.
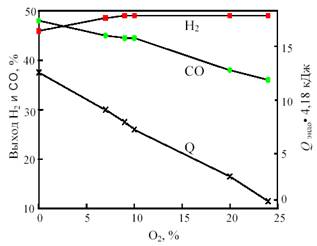 |
Рис. 12. Зависимость равновесного выхода Н2 и СО и теплового эффекта реакции (теплопоглощения) Qэндо при 800 °С и 0,1 МПа от содержания кислорода (x) в смеси 50% СН4 + (50-х)% СО2 + х% О2
Изменение соотношения исходных компонентов позволяет получить газ состава 1СО:1Н2 с одновременным сохранением термонейтральности. Например, исходная смесь, содержащая 38% СН4 , 43% СО2 и 19% СО2 , при 800 °С и 1 атм. дает продукт состава 36,0% Н2 и 36,4% СО при нулевом тепловом эффекте. При повышении температуры получается избыток СО: при 900 °С ─ 34,6% Н2 и 38,0% СО, а при снижении температуры ─ избыток Н2 : при 700 °С ─ 36,4% Н2 и 33,6% СО. В качестве примера на рис. 13 показана зависимость равновесного выхода СО и Н2 от температуры и давления для исходной смеси 38 % CH4 + 43% CO2 + 19% O2 .
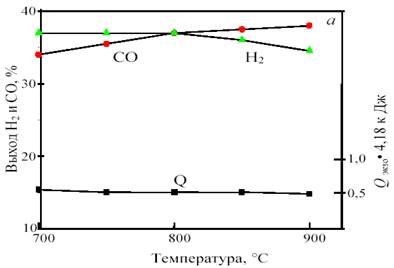
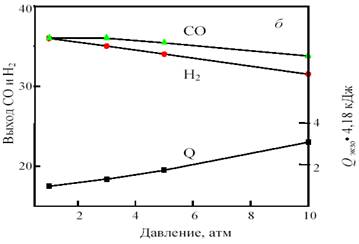
Рис. 13. Зависимость равновесного выхода Н2 и СО и теплового эффекта реакции (тепловыделения) Qэндо при 0,1 МПа от температуры (а) и при 800 °С от давления (б) в смеси 38%СН4 +43%CO2 + 19%O2
Важно отметить, что для этой смеси, в отличие от смеси 1СО:1Н2 , с ростом давления от 1 до 10 атм. равновесный выход продуктов уменьшается не намного, всего на 2─3%. Это позволяет интенсифицировать процесс путем увеличения давления без изменения соотношения продуктов и термонейтральности.
4.2 Кинетика углекислотной конверсии метана
Первой работой по кинетике углекислотной конверсии метана (3) была работа, выполненная в лаборатории М.И. Темкина [11]. Основываясь на схеме
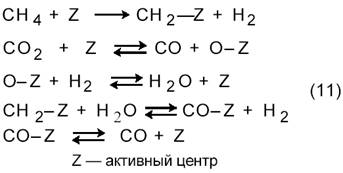 |
они показали, что в случае протекания процесса на никелевой фольге при 800─900 °С реакция описывается таким же кинетическим уравнением, что и паровая конверсия (1) на этом же катализаторе [27]:
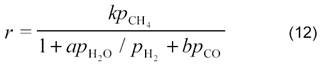
где k, a и b ─ константы; ρСН4 , ρН2О , ρН2 и ρСО ─парциальные давления метана, воды, водорода и СО, соответственно.
Если в смеси имеется водяной пар, то фактически протекает паровая конверсия СН4 с повторным быстрым образованием воды по реакции, обратной (6). В работе [11] подтверждается, что конверсия смесей СН4 +СО2 и СН4 +Н2 О на катализаторе Ni/МgО соответствует одинаковому кинетическому уравнению.
В дальнейшем были найдены и другие уравнения. Например, для реакции, соединяющей углекислотную конверсию метана (3) и паровую конверсию СО (6):
СН4 + 2СО2 → Н2 + Н2 О + 3СО (13)