Дипломная работа: Технология пиролиза углеводородного сырья в трубчатых печах
Другим важным параметром пиролиза является время пребывания пиролизуемых веществ в зоне реакции, называемое иногда временем контакта. Под временем пребывания понимают промежуток времени, в течение которого поток реагирующего вещества находится в реакционном змеевике при таких температурах, когда реакция пиролиза протекает с значительной скоростью. Условной температурой начала реакции в случае углеводородов С5 -С10 (прямогонный бензин) можно считать 650о С (см. Рисунок 1.2).
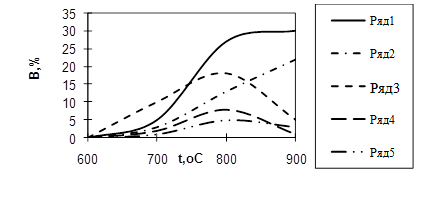
Рисунок 1.2 - Зависимость выходов В продуктов пиролиза прямогонного бензина в зотермическом реакторе от температуры t:
1 – С2 Н4 ; 2 – СН4 ; 3 – С3 Н6 ; 4 – С4 Н8 ; 5 – С4 Н6
Скорость первичных реакций, в ходе которых образуются олефины, в большей мере возрастает с увеличением температуры, чем скорость вторичных, и для каждого из промежуточных продуктов – низших олефинов – существует оптимальное, зависящее от температуры, время пребывания реагента, причем с повышением температуры величина оптимального времени пребывания уменьшается.
Таким образом, увеличение температуры пиролиза с одновременным соответствующим сокращением времени пребывания способствует достижению более высоких выходов целевых продуктов, в том числе этилена.
Для углеводородов C6 , при низкой температуре термодинамическая стабильность углеводородов разных классов при одинаковом числе углеводородных атомов в молекуле понижается:
Парафины > Нафтены > Олефины > Ароматические
Однако с ростом температуры ввиду разной зависимости изобарно изотермического потенциала от температуры порядок изменяется на обратный:
Ароматические > Олефины > Нафтены > Парафины
Таким образом, при термическом воздействии на нефтепродукты следует ожидать изменения группового состава углеводородов. Процесс расщепления парафина может происходить с образованием молекул олефинов и парафина с более короткой цепью углеродных атомов, причем обратный процесс представляет собой алкилирование парафина олефинов:
Сm+n H2(m+n)+2 ↔Cm H2m +Cn H2n+2 (1.7)
Примерно до 600К изменение энергии Гиббса (dGо ) больше нуля, и, следовательно, расщепление парафинов термодинамически невозможно, а может происходить лишь алкилирование. При более высокой температуре положение меняется на обратное, причем при 800К и выше расщепление является уже практически необратимым процессом [3].
Для олефинов склонность к расщеплению проявляется при более высокой температуре, чем для парафинов. В системе обратимых реакций пиролиза олефина и его димеризации (полимеризации)
Cm+n H2(m+n) ↔ Cm H2m + Cn H2n (1.8)
перемена знака в изменении dGo для низших олефинов происходит только при 750-800К. Это указывает на термодинамическую возможность их полимеризации при термическом и каталитическом пиролизе, но с преобладанием расщепления при более высоких температурах.
Известные законы термодинамики позволяют оценить роль давления при термическом расщеплении нефтепродуктов. Повышение давления способствует смещению равновесия в сторону полимеризации олефинов и алкилирования парафинов, поскольку данные реакции протекают с уменьшением объема. В связи с этим высокое давление препятствует глубокому расщеплению сырья и снижает образование углеводородов и особенно олефинов. Очевидно, понижение давления и повышения температуры должны действовать в обратном направлении.
1.1.2 Теоретические основы каталитического пиролиза
Теоретические основы процесса каталитического пиролиза в настоящее время изучены недостаточно.
В качестве активных компонентов катализаторов для пиролиза в публикациях, предлагаемые отечественными и зарубежными исследователями, предлагаются соединения многих элементов периодической системы, в большинстве случаев оксиды металлов переменной валентности (например: ванадия, индия, марганца, железа, хрома, молибдена и др.), оксиды и алюминаты щелочных и щелочноземельных металлов (большей частью кальция и магния) и редкоземельных элементов, а также кристаллические или аморфные алюмосиликаты [1].
С целью выявления особенности процесса был изучен каталитический пиролиз ряда индивидуальных углеводородов в присутствии катализатора на основе окисла металла переменной валентности [2]. Опыты проводили на лабораторной установке проточного типа в кварцевом реакторе со стационарным слоем катализатора. В качестве каталитической системы был использован ванадиево-кислый калий-мета, нанесённый в количестве 20% масс. на природный алюмосиликат – пемзу. Результаты исследования показывают, что в присутствии катализатора конверсия исходного углеводорода и выход продуктов реакции значительно выше, чем при термическом пиролизе, проведённом в аналогичных условиях. Сопоставление данных по каталитическому и термическому пиролизу при одинаковой конверсии свидетельствует об определённом влиянии катализатора на распределение продуктов реакции. Так, например при каталитическом пиролизе всех изученных углеводородов выход на разложенное сырьё водорода, метана, этилена и окислов углерода больше, а пропилена, углеводородов С4 и кокса меньше, чем при том же значении конверсии в условиях термического пиролиза. Однако принципиальных различий в составе продуктов каталитического и термического пиролиза не наблюдается, что даёт основание предположить, что каталитический пиролиз представляет собой гомогенный процесс с гетерогенными стадиями и протекает по радикальному механизму, свойственному термическому пиролизу.
Рассмотрим вероятный механизм каталитического пиролиза на примере пропана. Достаточно высокая активность катализатора пиролиза проявляется только при высоких температурах, что свидетельствует о большой роли гомогенного зарождения. Для пропана оно протекает по уравнению:
![]() (1.9)
(1.9)
Частично данная реакция может идти на поверхности катализатора. Это подтверждает энергия активации каталитического пиролиза пропана, которая составляет 182,1±5,4кДж/моль [4], в отличие от 239 кДж/кг [5] для термического пиролиза пропана, и свидетельствует о наличии гетерогенной составляющеё в стадии зарождения радикалов. Вместе с тем сравнительно высокое значение энергии активации ещё раз подтверждает большую роль гомогенного зарождения. Более вероятна на поверхности катализатора энергетически затруднённая реакция инициирования, заключающаяся в отрыве атома водорода от молекулы пропана:
![]() (1.10)
(1.10)
Для развития цепи распада приняли схему, аналогичную термическому пиролизу пропана. Экспериментальные данные [2] показывают, что состав продуктов каталитического пиролиза пропана удовлетворительно отвечает этой схеме. Особенностью каталитического процесса является то, что отдельные реакции указанные в схеме, протекают на поверхности катализатора, что и влечёт за собой некоторые различия в распределении продуктов каталитического и термического пиролиза:
![]() (1.11)
(1.11)
![]() (1.12)
(1.12)
![]() (1.13)
(1.13)