Контрольная работа: Этиленгликоль
Продукты реакции из нижней части реактора 2 через теплообменник 8 поступают в абсорбер 5 , где окись этилена поглощается водой. Непоглощенные газы компримируют и разделяют на три потока: один поток возвращают в реактор 2, другой направляют в колонну 3 через абсорбер 4 для отгонки СО2 и третий выводят из производственного цикла. Благодаря этому в системе поддерживается высокая концентрация этилена и предотвращается накопление в газах инертных примесей, главным образом двуокиси углерода.
Из нижней части абсорбера 5 водный раствор окиси этилена через теплообменник 8 направляют в колонный аппарат 9, где окись этилена отгоняют от воды, возвращаемой в абсорбер для абсорбции окиси этилена. В колонне 10 окись этилена отделяют от легколетучих примесей (СО2 , N2 , С2 Н4 ) и либо направляют на обезвоживание в колонну 12 для получения товарной окиси этилена, либо подвергают гидратации в этиленгликоли (реактор 11 ); последние концентрируют в аппарате 13 и разделяют в колонне 14.
Рисунок 4
Технологическая схема совместного производства окиси этилена и этиленгликолей:
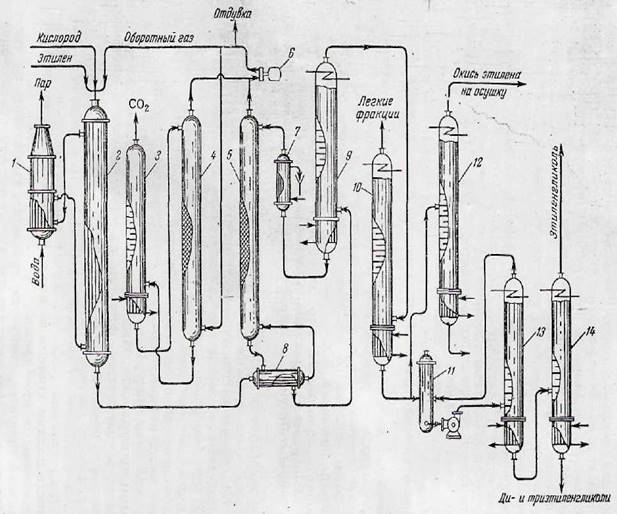
1 — котел-утилизатор; 2 — реактор; 3 — колонна для отгонки СО2 ; 4 — абсорбер СО2 ; 5 — абсорбер окиси этилена; б — компрессор; 7—холодильник; 3 — теплообменник; 9 — колонна для отгонки окиси этилена; 10 — колонна для отгонки легких компонентов; 11 — реактор для синтеза гликолей; 12 — колонии для обезвоживания окиси этилена; 13 — дегидрагатор; 14 — гликолевая колонна.
Применение этиленгликоля
При отщеплении молекулы воды от этиленгликоля путем его нагревания в присутствии водоотнимающих средств должна была бы образоваться окись этилена. Однако практически в зависимости от условий реакции (катализатор, температура) образуются полигликоли, а также диоксан или ацетальдегид.
При нитровании этиленгликоля концентрированной азотной кислотой в присутствии концентрированной серной кислоты образуется динитрат гликоля по взрывчатым свойствам равноценный нитроглицерину. На основе динитрата гликоля изготовляют динамиты, замерзающие при низкой температуре (—23°С). В качестве взрывчатых веществ применяют также продукты нитрования диэтиленгликоля альдегидами и кетонами этиленгликоль вступает в реакции, характерные для соединений, содержащих гидроксильную группу. Например, с ацетальдегидом он образует 2-метил-1, 3-диоксолан.
С двухосновными кислотами этиленгликоль образует линейные высокомолекулярные полиэфиры. Такие полиэфиры применяются как пленкообразующие вещества для лаков и красок, и особенно для производства синтетических волокон. Так, из этиленгликоля и диметилового эфира терефталевой кислоты получают полиэтилентерефталаты, из которых изготовляется волокно лавсан.
Будучи весьма гигроскопичным, этиленгликоль в то же время хорошо растворяет смолы, красители и некоторые вещества растительного происхождения. Благодаря сочетанию этих свойств этиленгликоль применяется при крашении тканей, в ситцепечатании, для приготовления штемпельных красок и косметических препаратов, для увлажнения табака и т. д. Так же этиленгликоль с успехом применяется для приготовления антифризов.
Список литературы:
1. Краткая химическая энциклопедия. Ред. кол. И.Л. Кнунянц (отв. ред) и др., т. 5 – М.. «Советская энциклопедия». 1961.
2. Лебедев Н. Н. Химия и технология основного органического и нефтехимического синтеза. 3-е изд., перераб. – М.: Химия, 1981 г. – 608с.
3. Писаренко А. П., Хавин З. Я. Курс органической химии. Учебник для вузов. Изд 3-е, перераб. И доп. М., «Высш. Школа», 1975. – 507с.
4. Петров А. А., Бальян Х.В., Прощенко А.Т. Органическая химия: Учебник для вузов. // Под ред. Стадничука М.Д. – 5-е изд., перераб и доп. – СПб.: «Иван Федоров». 2002. – 624с.
5. Юкельсон И.И. Технология органического синтеза – М.: Химия 1968 г. – 625с.